Cómo determinar el número de oxidación: una guía completa para comprender su importancia
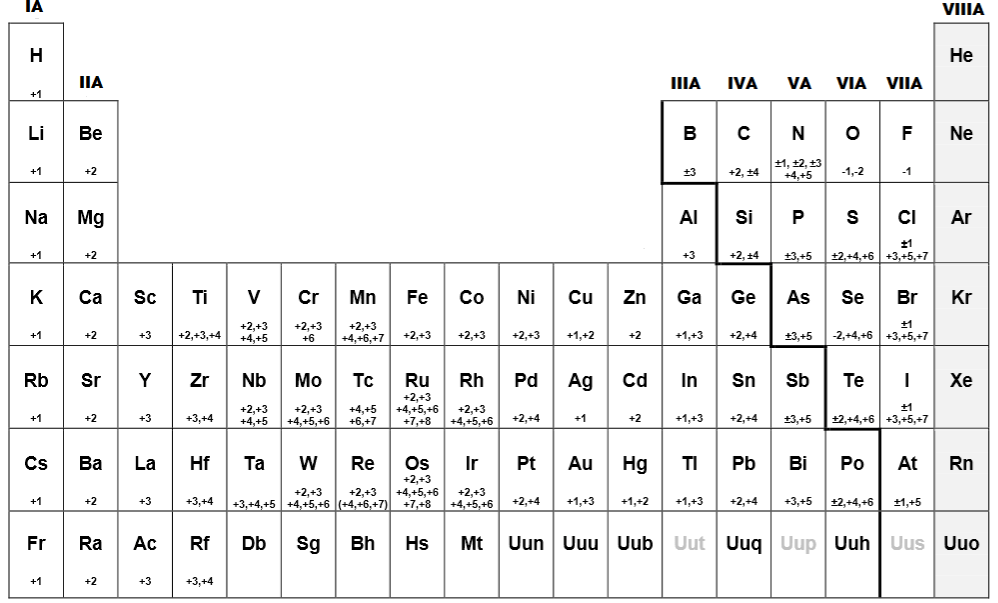
El número de oxidación es una propiedad fundamental en la química que permite determinar cómo los electrones son transferidos o compartidos entre átomos en una reacción química. Es una herramienta clave para entender la valencia de los elementos y las reacciones redox, y su correcto cálculo es crucial para balancear ecuaciones químicas y predecir el comportamiento de sustancias.
Exploraremos en detalle qué es el número de oxidación y cómo se puede determinar a partir de la configuración electrónica y la distribución de electrones en un átomo. También veremos cuáles son las reglas y convenciones utilizadas para asignar números de oxidación, y cómo estas pueden variar según el tipo de compuestos involucrados. Además, se proporcionarán ejemplos y ejercicios prácticos para afianzar los conceptos y habilidades necesarios para determinar el número de oxidación con precisión.
- Qué es el número de oxidación y por qué es importante entenderlo
- Cómo se determina el número de oxidación para un átomo en un compuesto químico
- Cuáles son las reglas básicas para asignar números de oxidación a los elementos
- Cuál es la importancia del número de oxidación en las reacciones químicas
- Cómo se puede determinar el número de oxidación en compuestos iónicos
- Cuál es la relación entre el número de oxidación y la transferencia de electrones
- Qué es el estado de oxidación y cómo se relaciona con el número de oxidación
- Cuáles son las aplicaciones prácticas del conocimiento de los números de oxidación
- Es posible tener múltiples números de oxidación para un mismo elemento en diferentes compuestos
- Cuál es el impacto del número de oxidación en la formación de iones y compuestos estables
Qué es el número de oxidación y por qué es importante entenderlo
El número de oxidación es una propiedad que se utiliza para determinar la carga eléctrica que un átomo tiene cuando forma parte de un compuesto químico. Es crucial entender el número de oxidación, ya que nos permite comprender cómo los elementos interactúan entre sí y cómo se forman las diferentes sustancias químicas.
Al comprender el número de oxidación de un átomo en un compuesto, podemos predecir cómo se llevarán a cabo las reacciones químicas y qué productos se formarán. Esta información es fundamental tanto en la química analítica como en la inorgánica, ya que nos permite determinar la estequiometría de una reacción y cuantificar las cantidades de los diferentes compuestos involucrados.
La importancia del número de oxidación también radica en su relación con la estabilidad de los compuestos. Los átomos tienden a alcanzar una configuración electrónica más estable al ganar o perder electrones, lo que se refleja en su número de oxidación. Comprender estos cambios en la carga eléctrica de los átomos nos permite predecir la reactividad de los elementos y cómo se comportarán en diferentes contextos.
Cómo determinar el número de oxidación
Determinar el número de oxidación de un átomo en un compuesto puede parecer complicado al principio, pero siguiendo ciertas reglas y considerando la estructura del compuesto, podemos deducirlo adecuadamente.
1. Regla del número de oxidación en un elemento libre: El número de oxidación de un elemento libre o sin combinar se considera cero. Esto se debe a que no hay interacción con otros elementos y, por lo tanto, la carga eléctrica es neutral.
2. Regla del número de oxidación en iones monovalentes: Los átomos que forman iones monovalentes (iones que tienen una carga de +/-1) tienen un número de oxidación igual a la carga del ion. Por ejemplo, el sodio (Na+) tiene un número de oxidación de +1, mientras que el cloruro (Cl-) tiene un número de oxidación de -1.
3. Regla del número de oxidación en compuestos neutros: Al analizar un compuesto neutro sin iones, podemos asignar los números de oxidación siguiendo las reglas siguientes:
- El hidrógeno generalmente tiene un número de oxidación de +1, pero cuando está combinado con un metal, puede tener un número de oxidación de -1.
- El oxígeno generalmente tiene un número de oxidación de -2, excepto en los peróxidos donde su número de oxidación es -1.
- Los halógenos (flúor, cloro, bromo, yodo) generalmente tienen un número de oxidación de -1, pero pueden tener números más altos en ciertos compuestos.
- La suma de los números de oxidación de todos los átomos en un compuesto neutro debe ser igual a cero.
4. Regla del número de oxidación en iones polivalentes: Para determinar el número de oxidación de un ion polivalente o de un elemento en un compuesto, utilizamos la carga del ion y la regla de neutralidad eléctrica para deducirlo. Por ejemplo, en el sulfato (SO4^2-), cada átomo de oxígeno tiene un número de oxidación de -2, por lo que el azufre debe tener un número de oxidación de +6 para que el compuesto sea neutro.
Es importante recordar que estas reglas son solo pautas generales y pueden haber excepciones en algunos casos. Además, en algunos compuestos más complejos, es necesario utilizar herramientas adicionales como las estructuras de Lewis o los diagramas de Wolff para determinar adecuadamente el número de oxidación de los átomos.
Entender el número de oxidación es crucial en química ya que nos permite predecir las reacciones y comprender cómo los elementos interactúan entre sí. Al seguir ciertas reglas y considerar la estructura de los compuestos, podemos determinar con precisión el número de oxidación de los átomos y utilizar esta información para realizar cálculos estequiométricos, analizar reactividades y comprender la estabilidad de los compuestos químicos.
Cómo se determina el número de oxidación para un átomo en un compuesto químico
El número de oxidación es un concepto fundamental en la química que nos permite conocer la carga eléctrica de un átomo en un compuesto químico. Es de vital importancia ya que con esta información podemos comprender cómo se llevan a cabo las reacciones químicas y cuál es la distribución de electrones en el compuesto.
Para determinar el número de oxidación de un átomo en un compuesto, debemos seguir algunos pasos clave. En primer lugar, es necesario conocer la estructura del compuesto y la ubicación del átomo en cuestión. Una vez que tenemos esta información, podemos utilizar ciertas reglas y métodos para calcular el número de oxidación de manera precisa.
Reglas para determinar el número de oxidación
A continuación, presentaremos algunas reglas básicas que nos ayudarán a determinar el número de oxidación de un átomo:
- En los elementos no combinados (átomos en estado elemental), el número de oxidación es siempre cero. Esto se debe a que no hay ganancia ni pérdida de electrones en estos casos.
- En algunos compuestos, como los metales alcalinos (grupo 1A) y los metales alcalinotérreos (grupo 2A), los átomos tienen siempre un número de oxidación positivo. Esta carga es igual al valor del grupo al cual pertenece el elemento en la tabla periódica.
- Cuando el átomo forma parte de un ion monovalente, el número de oxidación es igual a la carga del ion. Por ejemplo, en el ion cloruro (Cl⁻), el número de oxidación del átomo de cloro es -1.
- En los compuestos covalentes, como los hidrocarburos, los átomos de hidrógeno suelen tener un número de oxidación de +1. Sin embargo, existen excepciones a esta regla, como en los peróxidos donde el hidrógeno tiene un número de oxidación de -1.
- En los compuestos binarios no metálico-metal, la suma de los números de oxidación de los elementos debe ser cero.
Ejemplos prácticos de cálculo del número de oxidación
Vamos a analizar algunos ejemplos para poner en práctica las reglas mencionadas anteriormente:
Ejemplo 1: En el compuesto H₂SO₄, sabemos que el hidrógeno tiene un número de oxidación de +1 y el oxígeno de -2. Teniendo en cuenta estas cargas, podemos calcular el número de oxidación del azufre.
Cálculo: (-2) x 4 + (+1) x 2 = -8 + 2 = -6
Por lo tanto, el número de oxidación del azufre en el compuesto H₂SO₄ es +6.
Recuerda que la determinación del número de oxidación es esencial para comprender cómo se producen las reacciones químicas y cómo se distribuyen los electrones en los compuestos. Con estas reglas básicas y ejemplos, podrás realizar cálculos precisos del número de oxidación en diferentes compuestos.
Cuáles son las reglas básicas para asignar números de oxidación a los elementos
Regla del número de oxidación atribuido a un elemento no combinado
Cuando nos encontramos con un elemento en su forma más básica y sin combinarse con otros elementos, el número de oxidación atribuido siempre será cero. Esto se debe a que en su estado elemental, el elemento no ha ganado ni perdido electrones y, por lo tanto, su carga total es igual a cero.
Reglas para asignar números de oxidación en compuestos iónicos
En los compuestos iónicos, donde los elementos se encuentran combinados y forman iones, existen reglas específicas para determinar los números de oxidación de cada uno de ellos. A continuación, enumeraremos estas reglas:
- El número de oxidación de un catión (ion con carga positiva) equivale a su carga. Por ejemplo, si tenemos el ion Mg2+, el número de oxidación del magnesio es +2.
- El número de oxidación de un anión (ion con carga negativa) equivale al valor absoluto de su carga. Por ejemplo, el ion Cl- tiene un número de oxidación de -1.
- En un compuesto neutro, la suma de los números de oxidación de todos los elementos debe ser igual a cero. Por ejemplo, en el compuesto NaCl, el número de oxidación del sodio es +1 y el número de oxidación del cloro es -1, ya que su suma resulta en cero.
- En compuestos poliatómicos (compuestos que contienen varios átomos), la suma de los números de oxidación de todos los elementos también debe ser igual a cero. Por ejemplo, en el compuesto H2O, el número de oxidación del hidrógeno es +1 y el número de oxidación del oxígeno es -2, lo que da una suma total de cero.
Reglas para asignar números de oxidación en compuestos covalentes
En los compuestos covalentes, donde los átomos comparten electrones entre sí, también se aplican ciertas reglas para determinar los números de oxidación. Estas reglas son las siguientes:
- El elemento más electronegativo de un compuesto covalente generalmente tiene un número de oxidación negativo. El elemento menos electronegativo tendrá un número de oxidación positivo.
- Para conocer el número de oxidación de un elemento en un compuesto covalente, podemos utilizar la tabla de electronegatividades. Restamos la electronegatividad del elemento menos electronegativo de la electronegatividad del elemento más electronegativo y ese será el número de oxidación del elemento menos electronegativo.
Ejemplos prácticos para determinar el número de oxidación
Ahora que conocemos las reglas básicas para asignar números de oxidación, vamos a realizar algunos ejemplos prácticos para afianzar estos conceptos:
Ejemplo 1:
Determina el número de oxidación del azufre (S) en el compuesto SO42-.
Según las reglas para compuestos iónicos, el número de oxidación del oxígeno es -2. Sabiendo que la suma de los números de oxidación en este compuesto debe ser igual a -2 (porque es un ión con carga negativa), podemos realizar el siguiente cálculo:
(+x) + 4(-2) = -2
Resolviendo la ecuación, obtenemos:
x - 8 = -2x = -2 + 8x = 6
Por lo tanto, el número de oxidación del azufre en el compuesto SO42- es +6.
Ejemplo 2:
Determina el número de oxidación del carbono (C) en el compuesto CH4.
Como se trata de un compuesto covalente, primero debemos identificar el elemento más electronegativo y el menos electronegativo. En este caso, el carbono es el menos electronegativo y el hidrógeno es más electronegativo.
El hidrógeno siempre tiene un número de oxidación de +1, por lo que podemos hacer el siguiente cálculo:
x + 4(1) = 0
Resolviendo la ecuación, obtenemos:
x + 4 = 0x = -4
Entonces, el número de oxidación del carbono en el compuesto CH4 es -4.
Estas son algunas de las reglas básicas y ejemplos prácticos para determinar el número de oxidación en compuestos. Recuerda que es importante entender y dominar estos conceptos, ya que son fundamentales en el estudio de la química y su aplicación en distintas áreas científicas e industriales.
Cuál es la importancia del número de oxidación en las reacciones químicas
El número de oxidación, también conocido como estado de oxidación, es un concepto fundamental en la química que nos permite determinar el grado de oxidación o reducción de los elementos presentes en una sustancia. Es decir, nos indica cuántos electrones ha ganado o perdido un átomo durante una reacción química.
Comprender el número de oxidación es crucial para poder balancear ecuaciones químicas, predecir el tipo de reacciones que pueden ocurrir y entender cómo se producen las transformaciones químicas. La importancia radica en que nos permite conocer cómo se reorganizan los átomos en una reacción, lo que nos brinda información sobre los cambios en las propiedades físicas y químicas de las sustancias involucradas.
¿Cómo determinar el número de oxidación?
Determinar el número de oxidación puede parecer complicado al principio, pero existen reglas específicas que nos guían en este proceso. Primero, debemos saber que algunos elementos tienen un número de oxidación fijo, por ejemplo, los metales alcalinos siempre tienen un número de oxidación +1 y los metales alcalinotérreos tienen un número de oxidación +2.
Para determinar el número de oxidación de un elemento en una sustancia, es necesario analizar la distribución de electrones en su estructura atómica y tener en cuenta las reglas que rigen la asignación del número de oxidación. En general, estas reglas son:
- El número de oxidación de un elemento en su forma elemental es siempre 0.
- El número de oxidación de un ion monoatómico es igual a la carga del ion.
- El número de oxidación del hidrógeno es +1, excepto cuando está combinado con metales alcalinos, en cuyo caso su número de oxidación es -1.
- El número de oxidación del oxígeno es -2, excepto cuando forma peróxidos o está combinado con flúor, en cuyo caso su número de oxidación puede ser diferente.
Además de estas reglas generales, existen otras pautas para determinar el número de oxidación en compuestos más complejos, como las reglas de electronegatividad y la suma de los números de oxidación de los elementos en una molécula o ión.
Aplicaciones del número de oxidación
El número de oxidación tiene diversas aplicaciones en el campo de la química. Una de las principales es la capacidad que nos brinda para balancear ecuaciones químicas de manera adecuada. Al conocer el número de oxidación de cada elemento involucrado en una reacción, podemos asegurarnos de que se conserva la ley de la conservación de la masa y la carga eléctrica.
También nos ayuda a predecir el tipo de reacciones químicas que pueden ocurrir. Por ejemplo, si conocemos el número de oxidación de un elemento en una sustancia, podemos determinar si este experimentará una oxidación o una reducción durante la reacción.
Otra aplicación importante del número de oxidación es en el estudio de la química inorgánica. Nos permite entender cómo se forman los compuestos y las propiedades que poseen. Además, nos proporciona información sobre la estabilidad de las sustancias y su capacidad para reaccionar con otros compuestos.
El número de oxidación es una herramienta fundamental en la química que nos ayuda a comprender las transformaciones químicas. Su importancia radica en que nos permite determinar cómo se producen los cambios en las sustancias durante una reacción, lo cual resulta crucial para el estudio y aplicación de la química en diferentes campos.
Cómo se puede determinar el número de oxidación en compuestos iónicos
El número de oxidación en compuestos iónicos es una información crucial para comprender la estructura y propiedades de dichos compuestos. Determinar el número de oxidación nos ayuda a entender cómo se comparten o transfieren los electrones en las reacciones químicas, lo cual es fundamental para entender cómo se forman los enlaces iónicos.
Existen diferentes métodos para determinar el número de oxidación en compuestos iónicos. Uno de los métodos más comunes es utilizando la regla del octeto. Esta regla establece que los átomos tienden a ganar, perder o compartir electrones de manera que adquieran una configuración electrónica estable, similar a la de los gases nobles. Siguiendo esta regla, podemos determinar el número de oxidación asignando cargas formales a los átomos en función de los electrones de valencia.
Otro método utilizado es la utilización de tablas periódicas de electronegatividad. La electronegatividad es una medida de la capacidad de un átomo para atraer electrones hacia sí mismo en un enlace químico. Al comparar las electronegatividades de los átomos involucrados en un enlace iónico, podemos asignar cargas parciales a cada uno de ellos y determinar el número de oxidación en función de estas cargas.
Ejemplo de determinación del número de oxidación
Tomemos como ejemplo el compuesto iónico NaCl (cloruro de sodio). El cloruro de sodio está compuesto por iones de sodio (Na+) y cloruro (Cl-). El sodio tiene un número de oxidación de +1, ya que tiende a perder un electrón para adquirir la configuración electrónica del gas noble más cercano, el neón. Por otro lado, el cloruro tiene un número de oxidación de -1, ya que tiende a ganar un electrón para adquirir la misma configuración electrónica del argón.
Para determinar el número de oxidación en compuestos iónicos, podemos utilizar la regla del octeto y/o la electronegatividad de los átomos involucrados. Estos métodos nos permiten asignar cargas formales o parciales a los átomos y determinar su número de oxidación en función de estas cargas. Esta información es esencial para comprender la estructura y las propiedades de los compuestos iónicos, y es una herramienta fundamental en química inorgánica.
Cuál es la relación entre el número de oxidación y la transferencia de electrones
El número de oxidación es una propiedad fundamental en la química que nos permite comprender los procesos de transferencia de electrones en las reacciones químicas. Esta propiedad está relacionada con la distribución de los electrones en los átomos y su participación en los enlaces químicos.
Cuando un átomo experimenta un cambio en su número de oxidación, esto indica que ha ganado o perdido electrones durante una reacción química. La ganancia de electrones se conoce como reducción, mientras que la pérdida de electrones se denomina oxidación. Ambos procesos están estrechamente relacionados y ocurren simultáneamente en una reacción redox.
La transferencia de electrones entre diferentes especies químicas es esencial para el funcionamiento de muchos procesos biológicos y tecnológicos. Por ejemplo, en la respiración celular, los electrones son transferidos a través de una cadena transportadora de electrones para generar energía. En la electrólisis, la transferencia de electrones permite la descomposición de compuestos en sus elementos constituyentes.
Importancia del número de oxidación en la determinación de la estequiometría
El número de oxidación también juega un papel crucial en la determinación de la estequiometría de una reacción química. La estequiometría se refiere a la relación cuantitativa entre las cantidades de sustancias involucradas en una reacción.
Al conocer el número de oxidación de los elementos presentes en una ecuación química, podemos determinar la cantidad exacta de sustancias necesarias para que la reacción ocurra de manera completa. Esto nos ayuda a calcular las proporciones adecuadas y predecir la formación de productos en una reacción química.
La estequiometría también es fundamental para la síntesis y determinación de fórmulas químicas. Conociendo el número de oxidación de los elementos presentes en un compuesto, podemos deducir su fórmula molecular y estructura.
Métodos para determinar el número de oxidación
Existen varios métodos para determinar el número de oxidación de un elemento en una sustancia química. Uno de los métodos más comunes es utilizar las reglas del número de oxidación basados en la electronegatividad de los elementos.
Además, también se pueden utilizar techniques experimentales como espectroscopía y análisis electroquímico para determinar el número de oxidación de un elemento en una molécula o ion.
Ejemplo:
En una ecuación química, si el zinc (Zn) se oxida a Zn^2+ y simultáneamente el cobre (Cu^2+) se reduce a Cu, podemos determinar que el número de oxidación del zinc cambió de 0 a +2, mientras que el número de oxidación del cobre cambió de +2 a 0.
Qué es el estado de oxidación y cómo se relaciona con el número de oxidación
El estado de oxidación es una propiedad química que nos permite determinar la carga eléctrica real o ficticia de un átomo dentro de una molécula o compuesto. Se representa mediante el número de oxidación, el cual indica el número relativo de electrones que un átomo ha ganado o perdido al formar enlaces químicos. El conocimiento sobre el número de oxidación es fundamental para comprender cómo se llevan a cabo las reacciones químicas y cómo se establecen los enlaces entre los diferentes elementos.
El número de oxidación está relacionado con la distribución electrónica de los átomos y la tendencia que tienen estos a obtener la configuración electrónica más estable. Un átomo alcanza esta estabilidad al perder, ganar o compartir electrones con otros átomos, lo cual se refleja en su número de oxidación.
El número de oxidación puede ser positivo, negativo o incluso cero. Un número de oxidación positivo indica que el átomo ha perdido electrones, mientras que un número de oxidación negativo indica que ha ganado electrones. Por otro lado, cuando el número de oxidación es cero, significa que el átomo no ha ganado ni perdido electrones, es decir, se encuentra en estado puro.
Determinación del número de oxidación
Existen varias reglas o métodos que nos permiten determinar el número de oxidación en un átomo. A continuación, describiremos los más utilizados:
- Regla del número de oxidación general: Esta regla establece que el número de oxidación de un elemento en su estado libre o no combinado es cero. Por ejemplo, el número de oxidación del oxígeno (O2) es cero.
- Regla del hidrógeno: El número de oxidación del hidrógeno es +1 cuando se combina con no metales y -1 cuando se combina con metales.
- Regla del oxígeno: El número de oxidación del oxígeno en la mayoría de los compuestos es -2. Sin embargo, hay excepciones, como en los peróxidos donde su número de oxidación es -1.
- Regla de los halógenos: Los halógenos (flúor, cloro, bromo, yodo) tienen un número de oxidación de -1 en la mayoría de los compuestos. Hay algunas excepciones, como cuando se combinan entre ellos, donde pueden tener números de oxidación positivos.
- Regla del ión monoatómico: En un ión monoatómico, el número de oxidación es igual a la carga del ión. Por ejemplo, en el ion sodio (Na+), el número de oxidación del sodio es +1.
Estas son solo algunas de las reglas más utilizadas para determinar el número de oxidación. Es importante tener en cuenta que el número de oxidación puede variar dependiendo del compuesto en el que se encuentre el átomo, por lo que es necesario analizar cada caso de manera individual.
Importancia del número de oxidación
El número de oxidación es una herramienta fundamental en la química y tiene diversas aplicaciones e importancia tanto teórica como práctica. Algunas de las razones por las cuales el número de oxidación es importante son:
- Predicción de reacciones químicas: Conociendo el número de oxidación de los elementos involucrados en una reacción química, podemos predecir cómo se llevará a cabo dicha reacción. El número de oxidación nos permite identificar si se producirá una transferencia de electrones (reducción-oxidación) o si se establecerán enlaces covalentes.
- Balanceo de ecuaciones redox: Cuando se realizan reacciones de óxido-reducción, es necesario balancear las ecuaciones para que cumplan con la ley de conservación de la masa. El conocimiento del número de oxidación de los elementos involucrados es fundamental para lograr el balanceo adecuado.
- Identificación de compuestos y elementos: Al determinar el número de oxidación de un átomo en un compuesto dado, podemos identificar qué tipo de elemento o ion está presente. Esto nos brinda información importante sobre las propiedades y comportamiento de dicho compuesto.
- Análisis de la estructura electrónica: El número de oxidación también nos ayuda a comprender cómo se distribuyen los electrones en los diferentes orbitales y niveles energéticos de los átomos dentro de una molécula. Esto nos permite analizar la estructura electrónica y entender mejor las propiedades físicas y químicas de los compuestos.
El número de oxidación es una herramienta fundamental en la química que nos permite entender cómo se establecen los enlaces químicos y cómo se llevan a cabo las reacciones. Su determinación nos brinda información valiosa sobre la naturaleza de los compuestos y elementos, así como también nos ayuda a predecir y balancear las ecuaciones redox. Es una parte esencial en la comprensión de la química y su importancia radica en su aplicación en diversos campos de estudio e investigación.
Cuáles son las aplicaciones prácticas del conocimiento de los números de oxidación
La comprensión de los números de oxidación es fundamental en muchos campos de la química y tiene numerosas aplicaciones prácticas. Estas aplicaciones se extienden desde la determinación de la fórmula molecular hasta la predicción de la reactividad química y la comprensión de la estructura y propiedades de los compuestos.
Determinación de la fórmula molecular
Una de las principales aplicaciones del conocimiento de los números de oxidación es la determinación de la fórmula molecular de un compuesto. Los números de oxidación nos permiten identificar la cantidad relativa de átomos presentes en una molécula, lo que a su vez nos permite determinar la fórmula química precisa.
Por ejemplo, si sabemos que un elemento tiene un número de oxidación de +2 y otro elemento tiene un número de oxidación de -2, podemos inferir que se combinan en una proporción 1:1 para formar un compuesto neutro. Esta información nos ayuda a determinar la fórmula molecular correcta del compuesto.
Predicción de la reactividad química
Conocer los números de oxidación de los elementos también nos permite predecir su comportamiento químico y su reactividad. Los números de oxidación nos indican la facilidad con la que un elemento puede ganar o perder electrones durante una reacción química.
Los elementos con un número de oxidación bajo tienden a ser más reactivos y tienen una mayor tendencia a perder electrones. Por otro lado, los elementos con un número de oxidación alto tienden a ser más electronegativos y tienen una mayor tendencia a ganar electrones. Esta información nos permite predecir cómo los elementos interactuarán en una reacción química y qué tipo de compuestos se formarán.
Estructura y propiedades de los compuestos
El conocimiento de los números de oxidación también es crucial para comprender la estructura y las propiedades de los compuestos. Los números de oxidación están estrechamente relacionados con el concepto de enlace iónico y covalente, que son fundamentales para entender cómo los átomos se unen para formar moléculas y compuestos sólidos.
Además, los números de oxidación pueden influir en las propiedades físicas y químicas de los compuestos. Por ejemplo, los compuestos con números de oxidación altos tienden a tener puntos de fusión y ebullición más altos debido a las fuerzas de atracción más fuertes entre los iones o grupos de átomos cargados. Por otro lado, los compuestos con números de oxidación bajos tienden a ser más volátiles y pueden tener propiedades conductoras.
Las aplicaciones del conocimiento de los números de oxidación son variadas y abarcan desde la determinación de la fórmula molecular hasta la predicción de la reactividad y la comprensión de las propiedades de los compuestos. Es una herramienta esencial para cualquier químico y su dominio es fundamental para avanzar en nuestra comprensión y aplicación de la química.
Es posible tener múltiples números de oxidación para un mismo elemento en diferentes compuestos
El número de oxidación, también conocido como estado de oxidación, es una propiedad fundamental de los elementos químicos que nos permite comprender cómo los átomos ganan o pierden electrones en una reacción química. Aunque algunos elementos pueden tener un solo número de oxidación estable, muchos elementos pueden adoptar múltiples números de oxidación en diferentes compuestos.
Esta capacidad de los elementos para cambiar su número de oxidación es fundamental para entender la diversidad de compuestos químicos que existen en nuestro entorno. Al determinar el número de oxidación de un elemento en un compuesto, podemos predecir su comportamiento y participación en una reacción química.
¿Qué es el número de oxidación?
Antes de adentrarnos en cómo determinar el número de oxidación, es importante comprender qué es exactamente este concepto. El número de oxidación es una representación numérica de la carga eléctrica que un átomo tiene cuando forma un compuesto químico.
En un compuesto iónico, por ejemplo, los elementos ganan o pierden electrones para alcanzar la configuración electrónica estable de un gas noble. La cantidad de electrones ganados o perdidos se refleja en el número de oxidación del elemento. Un número de oxidación positivo indica una pérdida de electrones, mientras que un número negativo indica una ganancia de electrones.
Múltiples números de oxidación
Algunos elementos, como el hierro (Fe), pueden tener múltiples números de oxidación estables. Esto significa que pueden perder diferentes cantidades de electrones en diferentes reacciones químicas, resultando en diferentes números de oxidación.
Por ejemplo, el hierro puede tener un número de oxidación +2 en compuestos como el FeCl2, donde pierde dos electrones, o un número de oxidación +3 en compuestos como el FeCl3, donde pierde tres electrones. Esta variabilidad en los números de oxidación del hierro es clave para su participación en una amplia gama de reacciones químicas.
Determinación del número de oxidación
Existen varias reglas y métodos para determinar el número de oxidación de un elemento en un compuesto. Algunos de los enfoques más comunes incluyen:
- Regla de electroneutralidad: En muchos compuestos neutros, la suma de los números de oxidación de todos los elementos presentes debe ser cero.
- Reglas específicas para grupos de elementos: Algunos grupos de elementos tienen reglas específicas para determinar su número de oxidación. Por ejemplo, en los compuestos binarios que contienen oxígeno (O), este elemento siempre tiene un número de oxidación -2, excepto en peróxidos donde es -1.
- Cargas conocidas en iones poliatómicos: En algunos compuestos, podemos utilizar las cargas conocidas de iones poliatómicos para determinar el número de oxidación de otros elementos presentes en el compuesto.
Es importante recordar que estas reglas son solo pautas generales y pueden haber excepciones en ciertos casos. La determinación precisa del número de oxidación a menudo requiere un análisis más detallado de la estructura y las propiedades del compuesto en cuestión.
Comprender el número de oxidación es esencial para comprender cómo los elementos interactúan en una reacción química. La capacidad de los elementos para tener múltiples números de oxidación agrega aún más complejidad y diversidad al mundo de la química. Con las reglas y técnicas adecuadas, podemos determinar con precisión el número de oxidación de un elemento en un compuesto y utilizar esta información para predecir su participación en reacciones químicas.
Cuál es el impacto del número de oxidación en la formación de iones y compuestos estables
El número de oxidación es un concepto fundamental en la química. Nos permite determinar el grado de oxidación o reducción que experimentan los átomos en una reacción química. Esta propiedad es crucial para comprender la formación de iones y compuestos estables.
En primer lugar, debemos entender qué es el número de oxidación. Se trata de una carga eléctrica ficticia asignada a cada átomo en una molécula o ión. Esta carga representa la transferencia de electrones que ocurre durante una reacción química.
Para determinar el número de oxidación de un átomo en un compuesto, se siguen una serie de reglas establecidas. En general, los elementos en su estado elemental tienen un número de oxidación de cero. Por ejemplo, el oxígeno en O2 tiene un número de oxidación de cero.
Por otro lado, algunos elementos tienen números de oxidación fijos en ciertos compuestos. Por ejemplo, el hidrógeno siempre presenta un número de oxidación de +1, mientras que el flúor siempre tiene -1. Estos elementos son conocidos como monovalentes.
Además de los elementos monovalentes, existen otros elementos que pueden presentar diferentes números de oxidación, esto se debe a los distintos estados de oxidación que pueden adoptar. Por ejemplo, el manganeso puede tener números de oxidación desde -3 hasta +7 en diferentes compuestos.
Ahora bien, ¿cuál es el impacto del número de oxidación en la formación de iones y compuestos estables? La respuesta radica en la regla de la neutralidad eléctrica en los compuestos químicos. En un compuesto neutro, la suma de los números de oxidación de todos los átomos debe ser igual a cero.
Esta regla nos permite determinar los números de oxidación desconocidos de los átomos en un compuesto dado. Si conocemos los números de oxidación de algunos de los átomos presentes, podemos calcular el número de oxidación de los demás átomos para que la suma sea igual a cero.
Además, el número de oxidación influye en la estabilidad de un compuesto y en su capacidad para formar iones. Un compuesto con átomos altamente electronegativos, que tienen un número de oxidación negativo, tiende a ser más estable, ya que estos átomos aceptan electrones y se reducen.
Por otro lado, los átomos con un número de oxidación positivo tienden a perder electrones y se oxidan. Estos átomos son menos estables y pueden reaccionar fácilmente con otros compuestos para completar su configuración electrónica y alcanzar la estabilidad.
El número de oxidación es una herramienta indispensable para entender la formación de iones y compuestos estables. Nos permite determinar la carga eléctrica ficticia asignada a los átomos en un compuesto y nos ayuda a balancear las ecuaciones químicas asegurando la neutralidad eléctrica. Además, influye en la estabilidad de los compuestos y en su capacidad para formar iones mediante la transferencia de electrones.
El número de oxidación es la carga eléctrica que un átomo adquiere cuando forma parte de un compuesto químico.
Se determina analizando los electrones que los átomos ganan, pierden o comparten al formar un enlace químico.
Es importante porque nos permite entender cómo los átomos interactúan en los compuestos químicos y cómo se producen las reacciones químicas.
La oxidación implica la pérdida de electrones por un átomo, mientras que la reducción implica la ganancia de electrones por un átomo.
Los números de oxidación se utilizan para asignar prefijos y sufijos a los nombres de los compuestos, indicando la valencia relativa de los elementos involucrados.

Entradas relacionadas