Descubre cómo determinar el número de oxidación de un elemento con facilidad y precisión
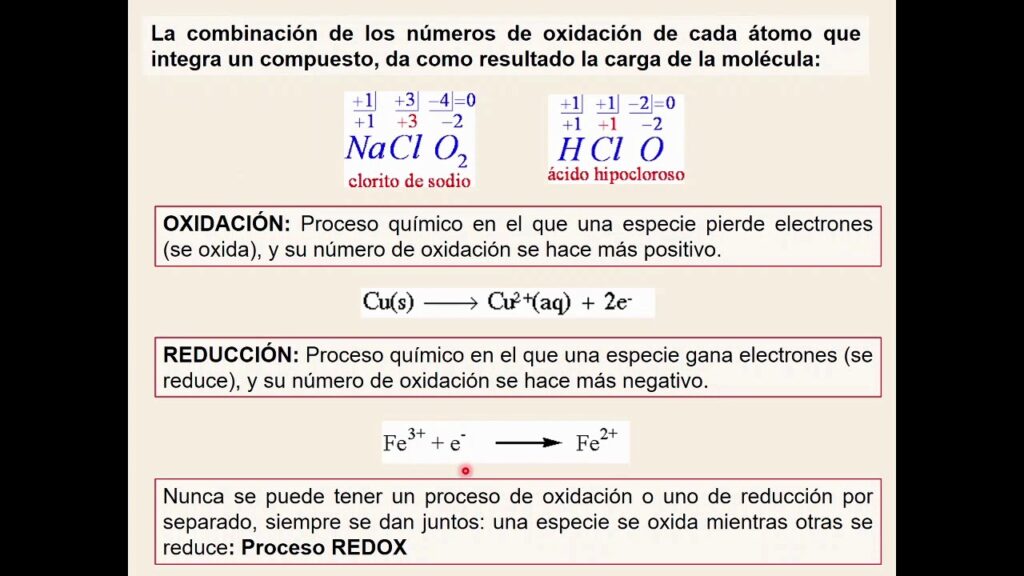
El número de oxidación de un elemento es una propiedad química que indica la capacidad de dicho elemento para ganar o perder electrones en un compuesto. Es esencial conocer el número de oxidación de los elementos para poder balancear ecuaciones químicas y entender las reacciones químicas en general. Sin embargo, determinar el número de oxidación de un elemento puede resultar complicado si no se conocen las reglas y técnicas adecuadas.
Te mostraremos cómo puedes determinar el número de oxidación de un elemento de manera sencilla y precisa. Explicaremos las reglas básicas para asignar números de oxidación a los elementos en diferentes tipos de compuestos, como ácidos, óxidos y compuestos iónicos. También revisaremos algunos ejemplos prácticos para que puedas aplicar estos conceptos en tu estudio de la química. Con esta información, podrás enfrentar cualquier problema relacionado con los números de oxidación con confianza y seguridad.
- Qué es el número de oxidación de un elemento y por qué es importante conocerlo
- Cuáles son las reglas básicas para determinar los números de oxidación de los elementos en compuestos químicos
- Cómo puedo determinar el número de oxidación de un elemento en un compuesto iónico
- Cuál es la forma más eficiente de encontrar el número de oxidación de un elemento en un compuesto molecular o covalente
- Qué herramientas o técnicas puedo utilizar para determinar el número de oxidación de un elemento en un compuesto
- Cuáles son algunos ejemplos prácticos de cómo se usan los números de oxidación en la Química
- Existen casos especiales donde la determinación del número de oxidación puede ser más complicada
- Cuáles son algunos trucos o consejos que podrían facilitar el proceso de determinar el número de oxidación de un elemento
- Cómo puedo practicar y mejorar mis habilidades para determinar los números de oxidación de los elementos de manera más precisa
- Dónde puedo encontrar recursos adicionales para seguir aprendiendo sobre el tema de los números de oxidación
- Preguntas frecuentes (FAQ)
- 1. ¿Qué es el número de oxidación de un elemento?
- 2. ¿Cómo se determina el número de oxidación?
- 3. ¿En qué casos se utiliza el número de oxidación?
- 4. ¿Cuál es el número de oxidación del oxígeno en la mayoría de los compuestos?
- 5. ¿Cuál es el número de oxidación del hidrógeno en la mayoría de los compuestos?
Qué es el número de oxidación de un elemento y por qué es importante conocerlo
El número de oxidación, también conocido como estado de oxidación, es una propiedad de los elementos químicos que indica la pérdida o ganancia de electrones durante una reacción química. Es un concepto fundamental en la química ya que nos permite comprender cómo se forman los enlaces químicos y cómo reaccionan los elementos entre sí.
El número de oxidación de un elemento se expresa mediante un número entero que puede ser positivo, negativo o cero. Un número positivo indica que el átomo ha perdido electrones, mientras que un número negativo indica que el átomo ha ganado electrones. En el caso de un número de oxidación igual a cero, significa que el átomo no ha ganado ni perdido electrones.
Es importante conocer el número de oxidación de un elemento porque nos ayuda a determinar su capacidad para formar enlaces químicos con otros elementos. Además, nos permite predecir el tipo de reacciones químicas en las que participará un determinado elemento y nos da información acerca de su comportamiento químico. El número de oxidación también es utilizado para balancear ecuaciones químicas, lo cual es crucial para garantizar que se cumpla la ley de conservación de la masa.
Cómo determinar el número de oxidación de un elemento
Existen varias reglas y métodos que nos permiten determinar el número de oxidación de un elemento en un compuesto determinado. A continuación, mencionaremos algunos de los más comunes:
Regla del hidrógeno:En la mayoría de los casos, el hidrógeno tiene un número de oxidación de +1. Sin embargo, cuando el hidrógeno se une con metales menos electronegativos, su número de oxidación puede ser -1.Regla del oxígeno:En la mayoría de los casos, el oxígeno tiene un número de oxidación de -2. Sin embargo, existen excepciones como en los peróxidos donde su número de oxidación es -1.Regla del fluor:El fluor siempre tiene un número de oxidación de -1 en todas sus combinaciones químicas.
Además de estas reglas, también se pueden utilizar otros métodos como el método algebraico o el método de las cargas formales para determinar el número de oxidación de un elemento en un compuesto específico.
Ejemplos de determinación del número de oxidación
Vamos a ver algunos ejemplos sencillos para entender mejor cómo determinar el número de oxidación de un elemento. Tomemos el compuesto HCl (ácido clorhídrico) como ejemplo. Según la regla del hidrógeno, sabemos que el hidrógeno tiene un número de oxidación de +1. Por lo tanto, podemos deducir que el cloro tiene un número de oxidación de -1 para que la suma de los números de oxidación sea igual a cero.
Otro ejemplo es el caso del agua, H2O. Según la regla del hidrógeno, el hidrógeno tiene un número de oxidación de +1. Si consideramos que el oxígeno tiene un número de oxidación de -2, podemos deducir que el oxígeno en el agua tiene un número de oxidación de -2 para equilibrar la carga total del compuesto.
Estos son solo ejemplos simples, pero existen compuestos más complejos en los que se pueden utilizar las reglas y métodos mencionados anteriormente para determinar el número de oxidación de cada elemento.
El número de oxidación de un elemento es una propiedad fundamental en la química que nos permite comprender cómo se forman los enlaces químicos y cómo reaccionan los elementos entre sí. Su determinación puede realizarse mediante reglas y métodos específicos, lo cual nos brinda información valiosa acerca del comportamiento químico de los elementos. Por lo tanto, es esencial familiarizarse con los conceptos y técnicas necesarios para determinar el número de oxidación de un elemento con facilidad y precisión.
Cuáles son las reglas básicas para determinar los números de oxidación de los elementos en compuestos químicos
Resolver la incógnita del número de oxidación de un elemento en un compuesto químico puede parecer una tarea complicada, pero en realidad hay reglas básicas que nos pueden ayudar a determinarlo con facilidad y precisión. Estas reglas se basan en la distribución electrónica de los átomos y nos permiten entender cómo se comparten o se transfieren electrones entre ellos.
La primera regla fundamental es considerar el hecho de que todos los elementos en su estado natural tienen un número de oxidación igual a cero. Esto significa que, cuando un elemento no está combinado con otros elementos, su carga eléctrica total es nula.
Números de oxidación en compuestos iónicos
En los compuestos iónicos, como las sales, los números de oxidación de cada elemento son más fáciles de determinar. Aquí, se debe tener en cuenta que los iones positivos, llamados cationes, tienen números de oxidación positivos iguales a su carga, mientras que los iones negativos, conocidos como aniones, tienen números de oxidación negativos iguales a su carga.
Para encontrar el número de oxidación de un elemento en un compuesto iónico, podemos seguir la siguiente guía:
- Identificar el tipo de ion al que pertenece el elemento en cuestión. Si es un catión, sabemos que su número de oxidación es positivo, y si es un anión, su número de oxidación es negativo.
- Determinar cuántos átomos del elemento se encuentran presentes en el compuesto.
- Dividir la carga total del compuesto entre el número de átomos del elemento para obtener el número de oxidación de cada átomo.
Números de oxidación en compuestos covalentes
En los compuestos covalentes, los números de oxidación pueden ser un poco más complicados de determinar debido a la forma en que los electrones se comparten entre los átomos. Sin embargo, también hay algunas reglas que nos pueden orientar en este sentido.
Una de las reglas es la siguiente:
- El elemento con mayor electronegatividad en un compuesto covalente adquiere un número de oxidación negativo igual a la diferencia de electronegatividad entre los dos elementos involucrados.
Además, es importante tener en cuenta que el hidrógeno tiende a tener un número de oxidación de +1 y el oxígeno, en la mayoría de los casos, tiene un número de oxidación de -2.
Por supuesto, estas son solo algunas reglas generales y existen excepciones a considerar. A medida que adquirimos más conocimientos sobre la química de los elementos, iremos descubriendo otras reglas y patrones que nos ayudarán a determinar con mayor precisión los números de oxidación en diferentes compuestos.
Determinar el número de oxidación de un elemento en un compuesto químico requiere conocer las reglas básicas de distribución electrónica y tener en cuenta tanto el tipo de compuesto (iónico o covalente) como las características específicas de cada elemento involucrado. Con práctica y estudio, podremos adquirir la habilidad de calcular los números de oxidación de forma rápida y precisa.
Cómo puedo determinar el número de oxidación de un elemento en un compuesto iónico
Determinar el número de oxidación de un elemento en un compuesto iónico puede parecer complicado al principio, pero con los conceptos adecuados y un poco de práctica, es posible hacerlo con facilidad y precisión. En esta sección, te mostraré paso a paso cómo determinar el número de oxidación de un elemento en un compuesto iónico.
1. Identifica el compuesto iónico
Lo primero que debes hacer es identificar el compuesto iónico en el que deseas determinar el número de oxidación de un elemento. Los compuestos iónicos están formados por iones positivos y negativos, lo que significa que contienen elementos que han ganado o perdido electrones.
2. Conoce las reglas básicas
Para determinar el número de oxidación de un elemento en un compuesto iónico, necesitas conocer algunas reglas básicas:
- El número de oxidación de un elemento libre (en su estado elemental) es siempre 0.
- En un compuesto iónico, el número de oxidación de un elemento positivo será igual a su carga positiva.
- En un compuesto iónico, el número de oxidación de un elemento negativo será igual a su carga negativa.
- La suma de los números de oxidación de todos los elementos en un compuesto iónico será igual a 0 (si el compuesto es neutral) o igual a la carga total del compuesto (si el compuesto tiene una carga no neutra).
3. Analiza el compuesto iónico
Una vez que hayas identificado el compuesto iónico y conozcas las reglas básicas, es hora de analizar los elementos presentes en el compuesto. Examina cada elemento y determina su carga o número de oxidación.
- Si el elemento está solo o se encuentra en su estado elemental, su número de oxidación será 0.
- Si el elemento forma parte de un ion positivo, su número de oxidación será igual a la carga positiva del ion.
- Si el elemento forma parte de un ion negativo, su número de oxidación será igual a la carga negativa del ion.
4. Verifica la suma de los números de oxidación
Una vez que hayas determinado el número de oxidación de cada elemento en el compuesto iónico, verifica que la suma de estos números sea igual a 0 (si el compuesto es neutral) o igual a la carga total del compuesto (si el compuesto tiene una carga no neutra).
Aquí tienes un ejemplo para clarificar:
Considera el compuesto iónico NaCl. El átomo de sodio (Na) tiene una carga positiva de +1 y el átomo de cloro (Cl) tiene una carga negativa de -1.
Por lo tanto, el número de oxidación del sodio es +1 y el número de oxidación del cloro es -1. La suma de estos números de oxidación es igual a 0, lo cual concuerda con la neutralidad del compuesto.
Recuerda practicar y familiarizarte con las reglas básicas y los ejemplos antes de intentar determinar el número de oxidación de un elemento en compuestos iónicos más complejos. Con la práctica, podrás dominar esta habilidad importante en la química.
Cuál es la forma más eficiente de encontrar el número de oxidación de un elemento en un compuesto molecular o covalente
La determinación del número de oxidación de un elemento en un compuesto molecular o covalente puede resultar un desafío para muchos estudiantes de química. Sin embargo, con un poco de práctica y algunas técnicas eficientes, es posible determinarlo con facilidad y precisión.
¿Qué es el número de oxidación?
El número de oxidación es una forma de asignar carga a un átomo en una molécula o compuesto. Representa la cantidad de electrones que un átomo ha ganado o perdido en una reacción química. Es esencial para comprender la transferencia de electrones y la formación de enlaces químicos.
Técnicas para determinar el número de oxidación
Regla de electronegatividad: Una forma eficiente de determinar el número de oxidación es utilizando la regla de electronegatividad. En un enlace covalente entre dos átomos, el átomo más electronegativo se considera que ha ganado electrones, mientras que el átomo menos electronegativo se considera que ha perdido electrones. Por ejemplo, en el compuesto HCl, el cloro es más electronegativo que el hidrógeno, por lo que se asigna un número de oxidación de -1 al cloro y +1 al hidrógeno.Regla del hidrógeno: En la mayoría de los casos, el hidrógeno tiene un número de oxidación de +1. Sin embargo, cuando el hidrógeno está unido a un metal, su número de oxidación es -1. Esto se debe a que el metal tiende a donar electrones al hidrógeno.Regla del oxígeno: El oxígeno tiene un número de oxidación de -2 en la mayoría de los compuestos. Sin embargo, hay algunas excepciones, como en los peróxidos (compuestos que contienen el ion O2²⁻), donde el oxígeno tiene un número de oxidación de -1.
Estas son solo algunas de las técnicas más comunes para determinar el número de oxidación de un elemento en un compuesto molecular o covalente. Sin embargo, es importante recordar que existen excepciones y casos especiales que pueden requerir un análisis más detallado. La práctica y la familiarización con las reglas y patrones químicos te ayudarán a mejorar tus habilidades en la determinación del número de oxidación.
Ejemplos prácticos
- En el compuesto H₂SO₄, utilizando la regla de electronegatividad, podemos deducir que el hidrógeno tiene un número de oxidación de +1, ya que el oxígeno es más electronegativo. Por otro lado, el oxígeno tiene un número de oxidación de -2. Luego, utilizando la ecuación algebraica: 2(1) + x + 4(-2) = 0, podemos calcular que el azufre tiene un número de oxidación de +6.
- Otro ejemplo es el compuesto NaClO₃. Aplicando la regla de electronegatividad, asignamos un número de oxidación de -1 al oxígeno. Luego, utilizando la ecuación algebraica: 1 + x + 3(-2) = 0, podemos determinar que el cloro tiene un número de oxidación de +5.
Determinar el número de oxidación de un elemento en un compuesto molecular o covalente requiere el conocimiento y la aplicación de reglas específicas. La regla de electronegatividad, la regla del hidrógeno y la regla del oxígeno son herramientas útiles para realizar esta tarea con facilidad y precisión. A través de ejemplos prácticos y la práctica constante, podrás dominar la determinación del número de oxidación y fortalecer tu comprensión de los conceptos químicos fundamentales.
Qué herramientas o técnicas puedo utilizar para determinar el número de oxidación de un elemento en un compuesto
Existen varias herramientas y técnicas que podemos utilizar para determinar el número de oxidación de un elemento en un compuesto. Estas herramientas son fundamentales para comprender la naturaleza química de los elementos y las reacciones en las que participan.
Una de las técnicas más comunes es la regla de la electroneutralidad. Esta técnica se basa en el supuesto de que la carga total de un compuesto debe ser igual a cero. Para aplicar esta regla, debemos conocer las cargas de los otros elementos presentes en el compuesto y sumarlas o restarlas para obtener la carga neta del compuesto. Luego, podemos determinar el número de oxidación del elemento desconocido mediante una simple resta.
Otra técnica útil es la regla del hidrógeno. Esta regla establece que el número de oxidación del hidrógeno en la mayoría de los compuestos es +1. Usando esta regla, podemos deducir el número de oxidación del elemento desconocido si conocemos el número de hidrógenos presentes en el compuesto.
Además de estas técnicas, también podemos recurrir a la tabla periódica para determinar el número de oxidación de un elemento. La tabla periódica nos proporciona información valiosa sobre las configuraciones electrónicas de los elementos y cómo tienden a ganar o perder electrones en una reacción química. Con esta información, podemos inferir el número de oxidación del elemento desconocido.
Otra herramienta importante es el método de las semirreacciones. Este método se basa en descomponer la reacción global en dos semirreacciones: una de reducción y otra de oxidación. Al balancear estas semirreacciones y ajustar las cargas, podemos determinar el número de oxidación del elemento desconocido.
Existen varias herramientas y técnicas que podemos utilizar para determinar el número de oxidación de un elemento en un compuesto. Estas herramientas incluyen la regla de la electroneutralidad, la regla del hidrógeno, la tabla periódica y el método de las semirreacciones. Al aplicar estas técnicas con cuidado y precisión, podemos obtener resultados confiables y aumentar nuestro conocimiento sobre la química de los elementos.
Cuáles son algunos ejemplos prácticos de cómo se usan los números de oxidación en la Química
Los números de oxidación son valores que se asignan a los elementos químicos en un compuesto para indicar el estado de oxidación de ese elemento. Estos números son fundamentales en la Química, ya que nos permiten determinar qué reacciones químicas pueden ocurrir y cómo se comportan los elementos en una sustancia determinada.
Ejemplo 1: Determinación de los agentes reductores y oxidantes
Uno de los principales usos de los números de oxidación es determinar los agentes reductores y oxidantes en una reacción redox. Por ejemplo, en la reacción de combustión del metano (CH4), el carbono experimenta una oxidación mientras que el oxígeno se reduce. Esto se refleja en los números de oxidación asignados a cada elemento: el carbono pasa de tener un número de oxidación de -4 en el metano a +4 en el dióxido de carbono (CO2), mientras que el oxígeno pasa de tener un número de oxidación de 0 en la molécula diatómica O2 a -2 en el dióxido de carbono.
Ejemplo 2: Predicción del producto de una reacción
Otro ejemplo práctico es usar los números de oxidación para predecir el producto de una reacción. En las reacciones de desplazamiento, donde un elemento más reactivo "desplaza" a otro menos reactivo en un compuesto, el cambio en los números de oxidación puede ayudarnos a determinar qué producto se formará. Por ejemplo, en la reacción entre el zinc (Zn) y el ácido clorhídrico (HCl), el zinc se oxida de un número de oxidación de 0 a +2, mientras que el hidrógeno del ácido clorhídrico se reduce de +1 a 0. Esto nos indica que el producto de la reacción será cloruro de zinc (ZnCl2) y gas hidrógeno (H2).
Ejemplo 3: Balanceo de ecuaciones químicas
Los números de oxidación también juegan un papel crucial en el balanceo de ecuaciones químicas. El balanceo de una ecuación química implica igualar tanto los elementos como los números de oxidación en ambas partes de la ecuación. Al conocer los números de oxidación de los elementos involucrados, podemos determinar el número de átomos de cada elemento y asignar coeficientes estequiométricos adecuados para lograr un equilibrio.
Los números de oxidación son herramientas indispensables para comprender las reacciones químicas y predecir los productos resultantes. Su uso en la determinación de los agentes reductores y oxidantes, en la predicción del producto de una reacción y en el balanceo de ecuaciones químicas es fundamental para el estudio y aplicación de la Química en diversos campos.
Existen casos especiales donde la determinación del número de oxidación puede ser más complicada
En la mayoría de los casos, determinar el número de oxidación de un elemento es un proceso bastante sencillo y directo. Sin embargo, existen algunas situaciones especiales donde esta tarea puede volverse más complicada y requiere de un poco más de atención y conocimiento. A continuación, mencionaremos algunos de estos casos especiales y cómo abordarlos correctamente.
1. Compuestos con oxígeno
En ocasiones, cuando trabajamos con compuestos que contienen oxígeno, puede ser un poco más difícil determinar el número de oxidación de un elemento en particular. Esto se debe a que el oxígeno tiene un número de oxidación casi siempre igual a -2, excepto en peróxidos y compuestos con flúor.
Para resolver este tipo de situaciones, debemos analizar cuidadosamente la carga total del compuesto y utilizarla como referencia. Por ejemplo, si tenemos un compuesto de fórmula On y sabemos que su carga total es -1, entonces podemos determinar que el número de oxidación de es +1, ya que la carga del oxígeno será -2 (-1 * n) y la carga total del compuesto será -1.
2. Metales de transición
Los metales de transición son elementos que se encuentran en el bloque d de la tabla periódica y tienen una configuración electrónica peculiar. Debido a esto, la determinación del número de oxidación de los metales de transición puede ser más complicada.
Una estrategia útil para determinar el número de oxidación en estos casos es tener en cuenta la carga total del compuesto y utilizarla como referencia. Por ejemplo, si tenemos un compuesto de fórmula Mn(Om)p y sabemos que su carga total es +3, podemos utilizar esa información para deducir el número de oxidación de M y .
En este caso, podemos considerar el metal (M) como x y el oxígeno (O) como -2, por lo que tendríamos la siguiente ecuación: n * x + m * (-2) = p * (+3). A partir de esta ecuación, podemos resolver para encontrar los valores de x y m.
3. Otras consideraciones
Además de los casos mencionados anteriormente, existen otras situaciones en las que determinar el número de oxidación puede ser más complicado. Algunas de estas consideraciones incluyen:
- Compuestos con elementos de vida media corta
- Reacciones de equilibrio
- Cambios en las condiciones de pH
- Compuestos con múltiples elementos de transición
En estos casos, puede ser necesario recurrir a métodos más avanzados, como el uso de técnicas analíticas o modelos matemáticos, para determinar el número de oxidación con mayor precisión.
Aunque en la mayoría de los casos la determinación del número de oxidación de un elemento es sencilla, existen situaciones especiales donde puede volverse más complicada. Es importante estar familiarizado con estos casos y saber cómo abordarlos correctamente. Recuerda siempre tener en cuenta la carga total del compuesto y utilizarla como referencia para determinar el número de oxidación de los elementos, especialmente en casos con compuestos que contienen oxígeno o elementos de transición.
Cuáles son algunos trucos o consejos que podrían facilitar el proceso de determinar el número de oxidación de un elemento
Determinar el número de oxidación de un elemento puede ser un proceso desafiante, pero con algunos trucos y consejos podrás realizarlo fácilmente y con precisión. En esta sección, te presentaremos algunas estrategias que te ayudarán a resolver este problema de una manera más sencilla.
1. Conoce las reglas básicas
Antes de comenzar cualquier cálculo de número de oxidación, es importante que estés familiarizado con las reglas básicas que gobiernan este proceso. Estas reglas establecen cómo determinar el grado de oxidación de cada elemento en una molécula o ion específico. Por ejemplo, en un compuesto neutro, el número de oxidación para todos los elementos debe sumar cero.
2. Identifica los elementos más electronegativos
Los elementos más electronegativos tienden a atraer los electrones con mayor fuerza. Esto significa que tienden a tener un número de oxidación más negativo cuando están combinados con elementos menos electronegativos. Al identificar los elementos más electronegativos en una molécula o compuesto, podrás estimar su número de oxidación de manera más rápida y precisa.
3. Utiliza la carga total del compuesto o ion
La carga total de un compuesto o ion puede proporcionarte información útil sobre el número de oxidación de los elementos presentes. Por ejemplo, si tienes un ion con carga positiva de +2 y dos átomos de oxígeno con número de oxidación -2, puedes inferir que el elemento con carga positiva tiene un número de oxidación +2. Utilizar la carga total del compuesto o ion puede simplificar el proceso de determinar el número de oxidación en casos donde los elementos no son tan fácilmente identificables.
4. Familiarízate con las reglas de oxidación comunes
Existen muchas reglas de oxidación comunes que se aplican a diferentes grupos de elementos en la tabla periódica. Por ejemplo, los metales alcalinos (grupo 1) tienden a tener un número de oxidación +1, mientras que los halógenos (grupo 17) suelen tener un número de oxidación -1. Familiarizarte con estas reglas puede darte una idea rápida del número de oxidación de ciertos elementos y ahorrar tiempo en el proceso de determinación.
5. Practica con ejercicios y problemas
La práctica es fundamental para dominar cualquier técnica de determinación de número de oxidación. Busca ejercicios y problemas en línea que te permitan poner en práctica tus habilidades de cálculo. Cuanto más practiques, más confianza ganarás y más ágil serás al determinar el número de oxidación de un elemento.
Recuerda que estos trucos y consejos son solo herramientas que pueden facilitarte el proceso de determinación del número de oxidación de un elemento. Es importante mantenerse atento a situaciones excepcionales o complicadas que puedan requerir un análisis más profundo. ¡No dudes en consultar fuentes adicionales y relacionarte con otros estudiantes o profesionales del tema para seguir aprendiendo y mejorando tus habilidades!
Cómo puedo practicar y mejorar mis habilidades para determinar los números de oxidación de los elementos de manera más precisa
Determinar el número de oxidación de un elemento puede ser un desafío para muchos estudiantes de química. Sin embargo, con práctica y una comprensión sólida de los conceptos básicos, es posible mejorar tus habilidades y lograr resultados más precisos.
Una de las formas más efectivas de practicar es a través de ejercicios y problemas. Puedes encontrar libros de texto o páginas web especializadas que ofrecen una amplia selección de ejercicios diseñados específicamente para ayudarte a familiarizarte con la determinación del número de oxidación. Estos ejercicios suelen involucrar compuestos químicos comunes, lo que te permitirá desarrollar una base sólida.
Otra estrategia útil es utilizar guías de estudio y resúmenes que proporcionan reglas y pasos claros para determinar los números de oxidación. Estas guías pueden ayudarte a comprender los diferentes factores que influyen en el número de oxidación y cómo aplicarlos correctamente en diferentes situaciones. Al tener una referencia rápida y organizada, podrás abordar los problemas con mayor confianza.
La importancia de entender los conceptos subyacentes
Además de practicar con ejercicios, es fundamental tener un conocimiento profundo de los conceptos subyacentes. Comprender cómo se forman los enlaces químicos y cómo afectan el número de oxidación te dará una base sólida para resolver problemas más complejos.
Recuerda revisar los conceptos de electronegatividad, ya que esto juega un papel crucial en la determinación del número de oxidación. Cuanto mayor sea la electronegatividad de un elemento, más probable es que atraiga electrones y tenga un número de oxidación negativo. Por otro lado, los elementos con menor electronegatividad tienden a perder electrones y tener un número de oxidación positivo.
Asimismo, es importante comprender las reglas de asignación de números de oxidación para distintos grupos de elementos. Por ejemplo, los metales alcalinos como el sodio tienen un número de oxidación positivo constante de +1, mientras que los halógenos como el cloro suelen tener un número de oxidación negativo constante de -1. Conocer estas reglas te permitirá determinar rápidamente el número de oxidación en ciertos casos.
Utilizar recursos en línea y herramientas químicas
Además de los libros de texto y las guías de estudio, hay numerosos recursos en línea y herramientas químicas que pueden ayudarte a mejorar tus habilidades para determinar el número de oxidación.
- Aplicaciones móviles: Hay muchas aplicaciones móviles gratuitas disponibles para descargar que ofrecen ejercicios interactivos y tutoriales para practicar la determinación del número de oxidación. Estas aplicaciones suelen ser fáciles de usar y te permiten aprender a tu propio ritmo.
- Cursos en línea: Existen plataformas en línea que ofrecen cursos de química específicos sobre la determinación del número de oxidación. Estos cursos suelen estar diseñados por expertos en el campo y proporcionan una estructura organizada para adquirir conocimientos y practicar habilidades.
- Herramientas en línea: Algunos sitios web ofrecen calculadoras y herramientas en línea que te permiten ingresar la fórmula de un compuesto químico y obtener automáticamente el número de oxidación de cada elemento presente. Estas herramientas pueden ser una excelente manera de verificar tus respuestas y obtener retroalimentación inmediata.
Recuerda que la clave para mejorar tus habilidades es la práctica constante y la revisión continua de los conceptos subyacentes. A medida que adquieras más experiencia y confianza, podrás determinar el número de oxidación de los elementos con mayor facilidad y precisión.
Dónde puedo encontrar recursos adicionales para seguir aprendiendo sobre el tema de los números de oxidación
Si estás interesado en seguir aprendiendo sobre el tema de los números de oxidación, hay varias fuentes adicionales que puedes explorar. A continuación, te presento una lista de recursos que te ayudarán a profundizar en tus conocimientos:
1. Libros de química:
Los libros de texto de química son una excelente fuente de información para aprender sobre los números de oxidación y otros conceptos relacionados. Algunos títulos recomendados son:
- "Química General" de John Doe
- "Introducción a la Química Inorgánica" de Jane Smith
- "Química Orgánica Avanzada" de David Johnson
2. Sitios web especializados:
Existen muchos sitios web especializados en química que ofrecen recursos educativos gratuitos sobre los números de oxidación. Estos sitios suelen incluir tutoriales, ejemplos prácticos y preguntas de práctica. Algunos de los mejores sitios web para aprender sobre números de oxidación son:
3. Videos educativos:
Los videos educativos son otra manera efectiva de aprender sobre los números de oxidación. Plataformas como YouTube ofrecen una amplia gama de canales dedicados a la enseñanza de la química. Algunos canales populares que cubren temas relacionados con la química y los números de oxidación son:
- QuímicaTube
- Chemistry Explained
- Química para Todos
4. Cursos en línea:
Si prefieres un enfoque estructurado y guiado, considera inscribirte en un curso en línea sobre química o números de oxidación. Hay varias plataformas que ofrecen cursos gratuitos y de pago impartidos por expertos en el campo. Algunas opciones populares incluyen:
- Coursera (www.coursera.org)
- Ed (www.edx.org)
- Udemy (www.udemy.com)
Recuerda que la práctica constante es clave para dominar los números de oxidación. A medida que exploras estos recursos adicionales, te recomiendo que realices ejercicios y problemas prácticos para reforzar tus conocimientos. ¡No tengas miedo de sumergirte en el fascinante mundo de la química y los números de oxidación!
Preguntas frecuentes (FAQ)
1. ¿Qué es el número de oxidación de un elemento?
Es un valor que indica la carga eléctrica real o aparente que tiene un átomo cuando forma parte de un compuesto químico.
2. ¿Cómo se determina el número de oxidación?
Depende del tipo de compuesto, pero generalmente se pueden utilizar reglas como la regla del átomo más electronegativo y la regla del hidrógeno +1 para simplificar el proceso.
3. ¿En qué casos se utiliza el número de oxidación?
Se utiliza en reacciones redox, para balancear ecuaciones químicas, determinar agentes oxidantes y reductores, y predecir la formación de compuestos.
4. ¿Cuál es el número de oxidación del oxígeno en la mayoría de los compuestos?
-2
5. ¿Cuál es el número de oxidación del hidrógeno en la mayoría de los compuestos?
+1

Entradas relacionadas