Descubre cómo se forma el enlace sigma y domina la química orgánica en 5 simples pasos
La química orgánica es una rama de la química que se encarga del estudio de los compuestos orgánicos, es decir, aquellos que contienen carbono. En esta disciplina, el enlace sigma juega un papel fundamental, ya que es el tipo de enlace más común entre dos átomos de carbono. Comprender cómo se forma y cómo afecta a las propiedades y reactividad de los compuestos orgánicos es esencial para dominar esta área de la química.
Te explicaremos en 5 simples pasos cómo se forma el enlace sigma y cómo se representa en las estructuras químicas. También exploraremos algunas características importantes de este tipo de enlace, como su solidez y direccionalidad. Al comprender estos conceptos fundamentales, estarás preparado para adentrarte en el fascinante mundo de la química orgánica y entender mejor la estructura y reactividad de los compuestos orgánicos.
- Qué es un enlace sigma y cómo se forma
- Cuál es la importancia del enlace sigma en la química orgánica
- Cuáles son los elementos que participan en la formación de un enlace sigma
- Cuáles son las características de un enlace sigma
- Cuál es la diferencia entre un enlace sigma y un enlace pi
- Cómo se representa un enlace sigma en una fórmula estructural
- Cuáles son las reglas básicas para formar un enlace sigma
- Cuál es el papel de los electrones en la formación de un enlace sigma
- Se pueden formar enlaces sigma entre átomos de diferentes elementos
- Por qué es importante entender la formación del enlace sigma para dominar la química orgánica
- Cuáles son algunas aplicaciones prácticas de los enlaces sigma en la vida cotidiana
- Cuáles son los errores comunes al intentar formar un enlace sigma y cómo evitarlos
- Cuál es el proceso paso a paso para formar un enlace sigma correctamente
- Preguntas frecuentes (FAQ)
Qué es un enlace sigma y cómo se forma
El enlace sigma es uno de los tipos de enlaces químicos más importantes en la química orgánica. Se forma cuando dos átomos comparten un par de electrones en una región de superposición orbital entre los núcleos de ambos átomos. Este tipo de enlace es muy fuerte y estable, lo que lo convierte en la base de muchas moléculas orgánicas.
Para entender cómo se forma un enlace sigma, es necesario comprender un poco sobre la teoría de orbitales moleculares. Según esta teoría, los átomos en una molécula se pueden describir mediante sus orbitales atómicos, que son regiones de espacio donde hay mayor probabilidad de encontrar un electrón. Cuando dos átomos se acercan lo suficiente, sus orbitales se mezclan para formar nuevos orbitales moleculares.
En el caso específico del enlace sigma, se forma una superposición de orbitales s o p. Los orbitales se solapan a lo largo del eje de unión de los átomos, permitiendo que los electrones sean compartidos entre ellos. Esta región de superposición se llama enlace sigma, porque se representa con la letra griega sigma (σ).
El proceso de formación de un enlace sigma puede dividirse en cinco simples pasos:
Paso 1: Acercamiento de los átomos
Los átomos que van a formar el enlace sigma deben acercarse lo suficiente para que sus orbitales puedan solaparse. El acercamiento se produce como resultado de las fuerzas electrostáticas entre los núcleos de los átomos y sus electrones. A medida que los átomos se acercan, la energía potencial disminuye.
Paso 2: Solapamiento de orbitales
Una vez que los átomos están lo suficientemente cerca, los orbitales s o p de cada átomo se solapan a lo largo del eje de unión. Esto significa que la región de superposición orbital se extiende entre los núcleos de los átomos implicados en el enlace sigma.
Paso 3: Formación de nuevos orbitales
El solapamiento de los orbitales da lugar a la formación de nuevos orbitales llamados orbitales moleculares sigma (σ). Estos nuevos orbitales son una combinación lineal de los orbitales atómicos originales, lo que significa que tienen una forma y orientación diferentes. Los electrones pueden ocupar estos nuevos orbitales, lo que resulta en la formación del enlace sigma.
Paso 4: Compartir de electrones
Una vez formados los orbitales moleculares sigma, los electrones pueden ocuparlos y ser compartidos entre los átomos. Este compartimiento de electrones es lo que da estabilidad al enlace sigma y permite que los átomos se mantengan unidos en la molécula. Cuanto mayor sea la cantidad de electrones compartidos, más fuerte será el enlace.
Paso 5: Estabilización de la molécula
Después de la formación del enlace sigma, la molécula se estabiliza debido a la disminución de su energía potencial. Los electrones compartidos en el enlace sigma se distribuyen de manera más uniforme entre los átomos, lo que reduce las repulsiones electrostáticas y aumenta la estabilidad de la molécula.
El enlace sigma es un tipo de enlace químico fuerte y estable que se forma cuando dos átomos comparten un par de electrones en una región de superposición orbital. Su formación implica el acercamiento de los átomos, el solapamiento de orbitales, la formación de nuevos orbitales, el compartir de electrones y la estabilización de la molécula resultante. Dominar el concepto del enlace sigma es fundamental para comprender la química orgánica y abrir las puertas a un mundo de posibilidades en este campo fascinante.
Cuál es la importancia del enlace sigma en la química orgánica
El enlace sigma es una estructura fundamental en la química orgánica que juega un papel crucial en la formación de moléculas. A través de este tipo de enlace, los átomos de carbono pueden unirse entre sí, permitiendo la construcción de cadenas y anillos de carbono que forman la base de los compuestos orgánicos.
La importancia del enlace sigma radica en su estabilidad y versatilidad. A diferencia de otros tipos de enlaces, como el enlace pi, el enlace sigma es más fuerte y resistente a la ruptura, lo que garantiza la integridad de las moléculas orgánicas. Además, la flexibilidad que proporciona el enlace sigma permite la rotación de los grupos funcionales alrededor de los átomos de carbono, lo que resulta en una amplia variedad de configuraciones y formas moleculares.
¿Cómo se forma el enlace sigma?
- El primer paso para formar un enlace sigma es la superposición de orbitales atómicos. Los átomos de carbono implicados en la formación del enlace deben tener orbitales p desocupados para permitir esta superposición.
- A medida que los orbitales p se acercan, comienza a producirse una superposición de los electrones presentes, lo que da lugar a la formación de una nuve de electrones compartidos. Esta nube de electrones compartidos es conocida como enlace sigma y se extiende en el espacio entre los dos átomos de carbono unidos.
- La formación del enlace sigma está acompañada de una liberación de energía. Esta energía se libera porque los electrones están en un estado de menor energía cuando están compartidos en un enlace, en comparación con cuando están localizados en los orbitales atómicos separados.
- Una vez que se ha formado el enlace sigma, los átomos de carbono quedan unidos y pueden formar cadenas o anillos más grandes a través de la repetición de este proceso de superposición e formación de enlaces sigma.
- Es importante tener en cuenta que un enlace sigma puede formarse entre dos átomos de carbono, pero también puede formarse entre un átomo de carbono y otros átomos como hidrógeno, oxígeno o nitrógeno. Esto permite la creación de una amplia variedad de moléculas orgánicas con diferentes propiedades y funciones.
El enlace sigma es esencial en la química orgánica debido a su estabilidad y versatilidad. A través de la superposición de orbitales atómicos, los átomos de carbono pueden formar enlaces sigma, lo que les permite unirse entre sí y formar cadenas y anillos de carbono. Comprender cómo se forma el enlace sigma es fundamental para dominar la química orgánica y explorar las diversas propiedades y aplicaciones de los compuestos orgánicos.
Cuáles son los elementos que participan en la formación de un enlace sigma
El enlace sigma es uno de los conceptos fundamentales en la química orgánica. Es la forma más básica y común de enlace químico que se encuentra entre dos átomos en una molécula. Para comprender cómo se forma el enlace sigma, es importante conocer los elementos que participan en su formación.
En primer lugar, los átomos que participan en la formación de un enlace sigma son conocidos como "átomos unidos". Estos átomos pueden ser de diferentes tipos y pertenecer a distintos elementos de la tabla periódica. Algunos ejemplos comunes incluyen el carbono (C), el hidrógeno (H), el oxígeno (O), y el nitrógeno (N).
El enlace sigma se forma mediante la superposición de orbitales híbridos de los átomos unidos. Los orbitales híbridos son combinaciones lineares de orbitales atómicos puros, que se mezclan para formar nuevos orbitales con características específicas. En el caso del enlace sigma, los orbitales puros pueden ser de tipo s, p o sp.
Una vez que los átomos unidos tienen sus orbitales híbridos, estos se superponen axialmente, es decir, a lo largo del eje internuclear. Esta superposición permite la formación de una región con densidad electrónica compartida, que es conocida como el enlace sigma. La densidad electrónica se encuentra concentrada en la dirección del enlace, lo que confiere a este tipo de enlace una alta estabilidad y resistencia.
Es importante destacar que el enlace sigma no se forma únicamente entre átomos unidos del mismo tipo. Por ejemplo, puede haber enlaces sigma entre carbono y hidrógeno, carbono y nitrógeno, o incluso entre diferentes átomos de carbono. La capacidad de formar enlaces sigma con diferentes átomos presenta una gran variedad de combinaciones posibles y contribuye a la complejidad y diversidad de las moléculas orgánicas.
El enlace sigma se forma mediante la superposición de orbitales híbridos de los átomos unidos. Este enlace se encuentra concentrado en la dirección del eje internuclear y resulta de vital importancia para comprender la química orgánica. Entender los elementos que participan en su formación y cómo se produce esta interacción nos permite adentrarnos en el fascinante mundo de las moléculas y sus propiedades.
Cuáles son las características de un enlace sigma
En el campo de la química orgánica, uno de los conceptos fundamentales es el enlace sigma. Este tipo de enlace se forma cuando dos átomos comparten un par de electrones que ocupan un orbital axialmente simétrico alrededor del eje entre los núcleos atómicos.
El enlace sigma es muy importante porque permite la formación de diferentes moléculas orgánicas y determina muchas de sus propiedades físicas y químicas. A continuación, conoceremos algunas de las características más relevantes de este tipo de enlace:
Elevada fuerza de atracción
La formación del enlace sigma implica la superposición de los orbitales atómicos de los átomos que están formando el enlace. Esta superposición permite una interacción fuerte entre los electrones compartidos y los núcleos de los átomos involucrados, lo cual genera una fuerza de atracción significativa entre ellos.
Orientación lineal
El término "sigma" hace referencia a la forma lineal que adopta este tipo de enlace. Los orbitales que entran en juego en la formación del enlace sigma son los puros s o sp, los cuales presentan una geometría lineal. Por lo tanto, el enlace sigma tiende a ser recto y dirigido axialmente hacia el eje entre los núcleos de los átomos involucrados.
Ausencia de deslocalización electrónica
Dado que el enlace sigma se produce a través de la superposición de orbitales atómicos axiales, no se generan deslocalizaciones electrónicas. Esto significa que los electrones compartidos en el enlace sigma permanecen entre los átomos involucrados y no se extienden a través de toda la molécula.
Flexibilidad
El enlace sigma permite cierta flexibilidad en términos de rotación alrededor del eje entre los átomos involucrados. Esto se debe a que los orbitales s y sp, que participan en la formación del enlace sigma, no tienen orientación espacial fija. Por lo tanto, es posible girar los átomos alrededor del enlace sigma sin romperlo.
El enlace sigma es un tipo de enlace fuerte y lineal que se forma a partir de la superposición de orbitales atómicos axiales. Este tipo de enlace es fundamental en la química orgánica, ya que determina muchas de las propiedades de las moléculas orgánicas. Además, su estructura lineal y flexibilidad permiten una variedad de interacciones moleculares y reacciones químicas.
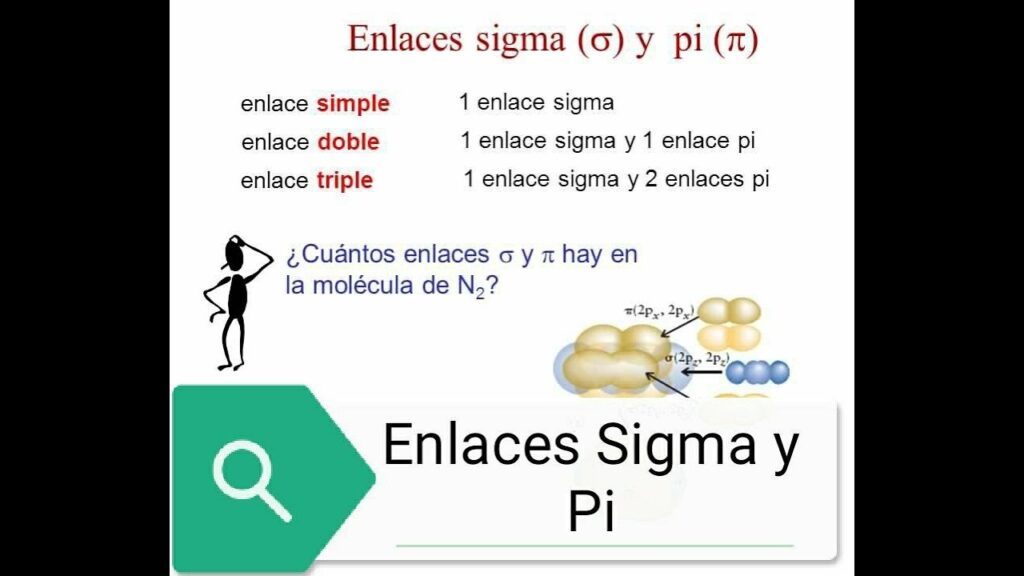
Cuál es la diferencia entre un enlace sigma y un enlace pi
En química orgánica, los enlaces sigma y pi son dos tipos fundamentales de enlaces covalentes presentes en las moléculas. La principal diferencia entre ellos radica en la orientación de los electrones en el espacio.
El enlace sigma (σ) se forma cuando dos átomos comparten un par de electrones a lo largo del eje del enlace. Esta unión es muy fuerte debido a la interacción directa de los núcleos atómicos con los electrones compartidos. En otras palabras, los orbitales híbridos que contribuyen al enlace sigma tienen una mayor superposición entre sí, lo que resulta en una mayor estabilidad y fuerza de unión.
Por otro lado, el enlace pi (π) se produce cuando dos átomos comparten un par de electrones pero con una orientación perpendicular al eje del enlace sigma. Esto significa que los electrones involucrados en este tipo de enlace no están directamente entre los núcleos, sino que forman una "nube" de electrones por encima y por debajo del plano de enlace. Debido a esta configuración electrónica, los enlaces pi son más débiles y menos estables que los enlaces sigma.
Es importante destacar que ambos tipos de enlaces pueden coexistir en una misma molécula. Por ejemplo, en los alquenos, un tipo de compuesto orgánico que contiene un enlace doble carbono-carbono, existe un enlace sigma entre los dos átomos de carbono y dos enlaces pi formados por los electrones restantes en los orbitales p no híbridos.
La diferencia fundamental entre un enlace sigma y un enlace pi radica en la orientación de los electrones compartidos. El enlace sigma es más fuerte y estable debido a una mayor superposición orbital, mientras que el enlace pi es menos fuerte y más débil debido a una menor superposición orbital. Ambos tipos de enlaces son fundamentales para comprender y dominar la química orgánica.
Cómo se representa un enlace sigma en una fórmula estructural
El enlace sigma es uno de los conceptos fundamentales en la química orgánica. Se representa en una fórmula estructural como un línea recta (-) entre los átomos que están unidos por este tipo de enlace.
Para entender mejor cómo se forma el enlace sigma, es importante comprender su naturaleza y características. En química orgánica, los enlaces sigma se refieren a los enlaces covalentes formados por la superposición de orbitales atómicos, donde los electrones compartidos se encuentran principalmente en el área central entre los dos átomos.
Cuando dos átomos se unen mediante un enlace sigma, sus orbitales híbridos o puros se solapan y comparten electrones de manera simétrica alrededor del eje de enlace. Esto genera una distribución de carga neutra a lo largo del enlace, lo que a su vez brinda estabilidad a la molécula.
Pasos para formar un enlace sigma
Paso 1:Identificar los átomos que formarán el enlace. Estos átomos deben ser capaces de compartir electrones de manera eficiente para establecer una conexión estable.Paso 2:Determinar los orbitales involucrados en la formación del enlace. Los átomos deben estar en la misma fase orbital (s, p, d, etc.) para que se produzca la superposición adecuada.Paso 3:Superponer los orbitales. Los orbitales deben estar alineados correctamente para lograr una máxima superposición y, por lo tanto, un enlace sigma fuerte y estable.Paso 4:Compartir los electrones. Una vez que los orbitales se han solapado adecuadamente, los electrones se comparten de manera simétrica entre los átomos, formando el enlace sigma.Paso 5:Verificar la estabilidad del enlace. Después de formar el enlace sigma, es importante evaluar su estabilidad en función de factores como la electronegatividad de los átomos, el tamaño de sus orbitales y la cantidad de electrones compartidos. Un enlace sigma más estable promoverá una molécula más estable en general.
El enlace sigma es una conexión covalente fuerte y estable que se forma mediante la superposición de orbitales atómicos. Siguiendo estos pasos, es posible comprender cómo se forma el enlace sigma y así dominar conceptos fundamentales en la química orgánica.
Cuáles son las reglas básicas para formar un enlace sigma
El enlace sigma es uno de los pilares fundamentales de la química orgánica. Es esencial comprender cómo se forma y qué reglas básicas debemos seguir para dominar la química orgánica. A continuación, te presento 5 simples pasos para entender cómo se forma el enlace sigma.
Paso 1: Conoce la estructura electrónica del átomo
Antes de adentrarnos en cómo se forma el enlace sigma, es importante tener claro cómo funciona la estructura electrónica de los átomos. En la formación de un enlace, los átomos comparten electrones para lograr una configuración más estable. Los átomos buscan alcanzar la configuración del gas noble más cercano, generalmente ocho electrones en la capa de valencia.
Paso 2: Comprende la hibridación de los orbitales
La hibridación de orbitales es un concepto clave para entender la formación del enlace sigma. En la química orgánica, los átomos pueden combinar sus orbitales atómicos para formar nuevos orbitales híbridos que son utilizados para la formación de enlaces químicos. Los orbitales híbridos pueden ser sp, sp2 o sp3, dependiendo del número de enlaces y pares de electrones solitarios alrededor del átomo.
Paso 3: Identifica los enlaces sigma en estructuras moleculares
Los enlaces sigma se representan mediante líneas rectas entre los átomos en una estructura molecular. Estos enlaces se forman cuando los orbitales híbridos de dos átomos se superponen y comparten electrones. Es importante identificar los enlaces sigma en una estructura molecular para entender su geometría y propiedades químicas.
Paso 4: Aprende a representar un enlace sigma
En la representación de estructuras moleculares, los enlaces sigma se indican generalmente con una línea recta (-) entre los átomos conectados. Esta línea representa el compartir de electrones entre los átomos y simboliza la formación del enlace sigma. Al dibujar estructuras moleculares, es esencial representar correctamente los enlaces sigma para una mejor comprensión visual.
Paso 5: Familiarízate con ejemplos de enlaces sigma
Para dominar la formación del enlace sigma, es útil estudiar ejemplos y prácticas. Existen numerosos ejemplos de moléculas orgánicas que contienen enlaces sigma, como el metano (CH4), el etano (C2H6) o el propano (C3H8). Al examinar y comprender estas moléculas, podrás observar cómo se forma el enlace sigma y cómo afecta a la geometría y las propiedades químicas de la sustancia.
La formación del enlace sigma es un proceso crucial en la química orgánica. Siguiendo los 5 simples pasos mencionados anteriormente, podrás aumentar tu comprensión y dominio de este concepto. Recuerda siempre conocer la estructura electrónica del átomo, comprender la hibridación de los orbitales, identificar los enlaces sigma en estructuras moleculares, aprender a representarlos correctamente y familiarizarte con ejemplos prácticos. ¡Con estos conocimientos, estarás un paso más cerca de dominar la química orgánica!
Cuál es el papel de los electrones en la formación de un enlace sigma
En la química orgánica, los enlaces sigma son fundamentales para entender cómo se unen los átomos en las moléculas. Estos enlaces se forman a través de la compartición de electrones entre dos átomos, lo que da lugar a una conexión fuerte y estable.
El papel de los electrones en la formación de un enlace sigma es crucial. Los electrones son partículas con carga negativa que orbitan alrededor del núcleo del átomo. En un enlace sigma, dos átomos comparten un par de electrones en su órbita externa, creando así una conexión entre ellos.
Para entender esto mejor, es necesario conocer el concepto de orbital. Un orbital es una región del espacio alrededor del núcleo de un átomo donde la probabilidad de encontrar un electrón es alta. Cada orbital tiene una capacidad máxima para dos electrones con espines opuestos.
Cuando dos átomos se acercan lo suficiente, sus orbitales se superponen, lo que significa que comparten una región común del espacio. En esta región de superposición, los electrones de ambos átomos tienen una probabilidad alta de encontrarse, lo que lleva a la compartición de electrones y a la formación del enlace sigma.
La fuerza del enlace sigma depende de varios factores, como la estabilidad de los átomos involucrados y la cantidad de electrones compartidos. Cuanto mayor sea la estabilidad de los átomos y cuanto más electrones compartan, más fuerte será el enlace sigma.
Es importante destacar que los enlaces sigma son sólo uno de los tipos de enlaces químicos. Además de los enlaces sigma, también existen los enlaces pi, los cuales se forman a través de la compartición de electrones en orbitales p.
El papel de los electrones en la formación de un enlace sigma es vital. A través de la compartición de electrones entre dos átomos, se crea una conexión fuerte y estable que es fundamental para la química orgánica. La formación de enlaces sigma depende de la superposición de orbitales y de factores como la estabilidad y la cantidad de electrones compartidos.
Se pueden formar enlaces sigma entre átomos de diferentes elementos
El enlace sigma es uno de los conceptos fundamentales en química orgánica. Es el tipo de enlace más común y se forma debido a la superposición de orbitales atómicos. Aunque tradicionalmente se asocia con la formación de enlaces entre átomos de carbono, también se pueden formar enlaces sigma entre átomos de diferentes elementos.
La formación de un enlace sigma implica la superposición frontal de los orbitales atómicos. Esto significa que los electrones de dos átomos comparten una región común de alta densidad electrónica ubicada en el eje entre los núcleos de los átomos.
Para entender cómo se forma un enlace sigma, es útil seguir estos 5 simples pasos:
Paso 1: Identifica los átomos que formarán el enlace
Antes de formar un enlace sigma, debemos identificar los átomos que participarán en él. Estos átomos deben tener orbitales híbridos que sean capaces de superponerse entre sí de manera frontal.
Paso 2: Determina los tipos de orbitales involucrados
Cada átomo tiene orbitales atómicos disponibles para la formación de enlaces. Estos orbitales pueden ser s, p, d o f, dependiendo del elemento y su configuración electrónica. Es importante determinar qué tipos de orbitales se utilizarán para la formación del enlace sigma.
Paso 3: Realiza la superposición frontal de los orbitales
Una vez que hemos identificado los átomos y determinado sus orbitales, podemos realizar la superposición frontal de los mismos. Esto implica alinear los orbitales en el eje entre los núcleos y permitir que los electrones ocupen una región común de alta densidad electrónica.
Paso 4: Calcula la longitud y la energía del enlace
Después de realizar la superposición frontal de los orbitales, podemos calcular la longitud y la energía del enlace sigma resultante. La longitud del enlace depende de la distancia entre los núcleos de los átomos involucrados, mientras que la energía está relacionada con la estabilidad del enlace.
Paso 5: Analiza las propiedades del enlace sigma formado
Una vez que se ha formado el enlace sigma, es importante analizar sus propiedades químicas y físicas. Estas propiedades pueden incluir la polaridad del enlace, la fuerza del enlace y su reactividad.
Los enlaces sigma son fundamentales en la química orgánica y se forman mediante la superposición frontal de orbitales atómicos. Siguiendo los 5 simples pasos mencionados anteriormente, podemos comprender cómo se forma un enlace sigma y dominar la química orgánica.
Por qué es importante entender la formación del enlace sigma para dominar la química orgánica
La formación del enlace sigma es un concepto fundamental en química orgánica que todo estudiante o profesional de esta disciplina debe comprender a fondo. Este tipo de enlace es crucial para entender y predecir las reacciones químicas en moléculas orgánicas, ya que juega un papel integral en la estructura y reactividad de los compuestos.
Un enlace sigma se forma cuando dos orbitales híbridos se superponen de manera axialmente, creando una conexión fuerte entre dos átomos. Esta conexión no solo mantiene unidos a los átomos, sino que también les permite compartir electrones de manera eficiente.
Para entender cómo se forma este enlace, es importante tener conocimiento sobre los orbitales atómicos y su hibridación. Los orbitales son regiones en el espacio donde existe mayor probabilidad de encontrar un electrón. Estos pueden ser s, p, d o f, dependiendo de la energía y la forma del orbital.
1. Hibridación de orbitales
En la hibridación de orbitales, los orbitales atómicos se combinan para formar nuevos orbitales híbridos. Esto ocurre bajo ciertas condiciones, como la necesidad de explicar la geometría molecular y la distribución espacial de los electrones en una molécula. Los cuatro tipos principales de hibridación son sp, sp2, sp3 y sp3d.
Durante la formación de un enlace sigma, los átomos involucrados combinan sus orbitales híbridos para lograr una superposición axial. Por ejemplo, en un enlace sigma entre dos átomos de carbono, cada átomo contribuye con un orbital híbrido sp2 para formar un enlace sigma entre ellos.
2. Superposición axial
La superposición axial es el proceso mediante el cual los orbitales híbridos o los orbitales atómicos se solapan directamente a lo largo del eje de enlace. Esto permite la formación de enlaces sigma fuertes y estables. La superposición axial puede ser clasificada como superposición de orbital s-s, p-p, s-p o p-d, dependiendo de los tipos de orbitales involucrados.
En el caso de un enlace sigma s-s, dos orbitales s híbridos se superponen axialmente, lo que resulta en una conexión fuerte entre los átomos. En un enlace sigma p-p, dos orbitales p híbridos también se superponen axialmente, creando un enlace fuerte y rígido entre los átomos.
3. Distribución electrónica
Una vez formado el enlace sigma, los átomos comparten electrones de manera efectiva, permitiendo que la molécula logre una distribución energéticamente favorable de electrones. Esta distribución electrónica es clave para entender las propiedades y reactividad de los compuestos orgánicos.
En un enlace sigma, los electrones son compartidos en un área de alta densidad electrónica ubicada a lo largo del eje de enlace. Esta región de alta densidad electrónica es resultado de la superposición axial de los orbitales híbridos y determina la naturaleza fuerte y estable del enlace.
4. Importancia en la reactividad química
El enlace sigma es esencial para comprender y predecir las reacciones químicas en moléculas orgánicas. La fuerza y estabilidad de este enlace influirán directamente en la facilidad con la que se rompe o forma durante una reacción química.
Además, conocer la formación del enlace sigma permite entender cómo se pueden construir estructuras moleculares más complejas a partir de enlaces más simples. Por ejemplo, la formación de enlaces sigma múltiples, como los enlaces dobles o triples, requiere una mayor superposición axial de orbitales, lo que implicará una mayor energía y reactividad en comparación con los enlaces sigma simples.
5. Aplicaciones en la industria y la investigación
El entendimiento de la formación y la reactividad del enlace sigma es crucial en muchos campos de la industria y la investigación química. Permite el diseño racional de nuevos compuestos, la optimización de procesos sintéticos y la comprensión de propiedades relevantes en áreas como la farmacología y la fabricación de materiales.
Comprender cómo se forma el enlace sigma es fundamental para dominar la química orgánica. Esto nos brinda un conocimiento más profundo de la estructura y reactividad de las moléculas, permitiéndonos predecir y controlar las reacciones químicas. Además, su aplicación en áreas como la industria y la investigación demuestra su relevancia y utilidad en el mundo científico actual.
Cuáles son algunas aplicaciones prácticas de los enlaces sigma en la vida cotidiana
Los enlaces sigma son fundamentales en la química orgánica y tienen diversas aplicaciones prácticas en nuestra vida cotidiana. Estos enlaces son los más fuertes y estables, lo que los hace ideales para una variedad de usos.
1. Plásticos
Los enlaces sigma se encuentran en muchos tipos de plásticos, como el polietileno y el polipropileno. Estos enlaces proporcionan fuerza y estabilidad estructural a los polímeros, lo que les permite resistir la tensión y mantener su forma. Gracias a los enlaces sigma, los plásticos se han convertido en materiales indispensables en una amplia gama de productos, desde envases hasta dispositivos electrónicos.
2. Medicamentos
En la industria farmacéutica, los enlaces sigma juegan un papel clave en la síntesis de medicamentos. Los químicos utilizan reacciones químicas para formar enlaces sigma entre diferentes moléculas, lo que les permite construir compuestos complejos con propiedades terapéuticas específicas. Así, los enlaces sigma son esenciales para la creación de fármacos que tratan diversas enfermedades y mejoran la calidad de vida de las personas.
3. Combustibles
Los enlaces sigma también desempeñan un papel importante en la industria de los combustibles. En los motores de combustión interna, el combustible se quema en presencia de oxígeno para producir energía. Durante este proceso de combustión, los enlaces sigma en los hidrocarburos se rompen y liberan energía. Además, la producción de combustibles fósiles implica procesos químicos que dependen de la formación y rompimiento de enlaces sigma.
4. Pigmentos
Ciertos pigmentos utilizados en pinturas, tintes y productos cosméticos contienen enlaces sigma. Estos pigmentos proporcionan color a los materiales y su estabilidad se debe a los enlaces sigma presentes en su estructura molecular. Gracias a estos enlaces, los pigmentos pueden resistir la decoloración causada por la luz, el calor y otros factores ambientales.
5. Plaguicidas
Los enlaces sigma son cruciales en la creación de plaguicidas y herbicidas utilizados en la agricultura para proteger los cultivos de plagas y malezas. Los compuestos químicos utilizados en estos productos contienen enlaces sigma que les confieren propiedades tóxicas para los organismos no deseados. Estos enlaces son esenciales para la efectividad de los pesticidas y ayudan a garantizar una agricultura más productiva y sostenible.
Cuáles son los errores comunes al intentar formar un enlace sigma y cómo evitarlos
El enlace sigma es uno de los conceptos fundamentales en química orgánica. Es la conexión covalente más fuerte, formada por la superposición directa de los orbitales atómicos de dos átomos. Dominar cómo se forma el enlace sigma es crucial para comprender la química orgánica y poder realizar reacciones interesantes y complejas.
Sin embargo, muchos estudiantes de química orgánica enfrentan desafíos al tratar de formar un enlace sigma. Estos desafíos pueden ser provocados por errores comunes que se cometen durante la formación del enlace. En esta sección, exploraremos algunos de los errores más frecuentes y cómo evitarlos.
Error 1: Mala elección de los átomos
Una de las principales razones por las que se encuentran dificultades para formar un enlace sigma es seleccionar incorrectamente los átomos involucrados en el enlace. Para formar un enlace sigma fuerte, es importante elegir átomos que tengan una buena superposición de orbitales y sean capaces de compartir electrones de manera eficiente.
La solución a este problema es entender la electronegatividad de los átomos y cómo afecta su capacidad para formar enlaces sigma. Los átomos con electronegatividades similares tienden a tener una mejor superposición orbital y son más propensos a formar enlaces sigma fuertes.
Error 2: Falta de hibridación adecuada
La hibridación de los orbitales es un paso clave en la formación de enlaces sigma. Los orbitales híbridos permiten una superposición más eficiente y estabilizan la estructura del enlace.
Uno de los errores comunes es no tener en cuenta la hibridación adecuada de los átomos antes de intentar formar un enlace sigma. Es importante recordar que los átomos pueden hibridarse de diferentes maneras, como sp, sp2 o sp3, dependiendo de su geometría molecular. Utilizar orbitales híbridos incorrectos puede llevar a debilidades en el enlace y dificultades para formarlo.
Error 3: Falta de orientación correcta
La orientación de los átomos durante la formación del enlace sigma también puede afectar su fortaleza y estabilidad. Un error común es no tener en cuenta la posición correcta de los átomos y sus grupos funcionales relacionados.
Para evitar este error, es importante considerar la geometría molecular y las posiciones relativas de los átomos involucrados en el enlace. Tener una orientación adecuada asegurará una superposición orbital óptima y un enlace sigma fuerte.
Error 4: Cargas formales desequilibradas
Otro error común es no tener en cuenta las cargas formales de los átomos involucrados en el enlace sigma. Las cargas formales desequilibradas pueden generar inestabilidades y dificultades en la formación del enlace.
Es importante verificar las cargas formales de los átomos y asegurarse de que estén equilibradas. Esto se logra distribuyendo adecuadamente los electrones de valencia en la estructura. Un equilibrio de cargas formales contribuirá a una formación más efectiva del enlace sigma.
Error 5: Falta de práctica y comprensión
Por último, pero no menos importante, un error común es la falta de suficiente práctica y comprensión de los conceptos relacionados con la formación del enlace sigma. La química orgánica requiere tiempo y dedicación para dominarla por completo.
Para evitar este error, se recomienda practicar regularmente la formación de enlaces sigma y comprender los principios subyacentes detrás de ella. Esto se puede lograr a través de ejercicios, problemas y la búsqueda de recursos adicionales que brinden una visión más profunda sobre el tema.
Formar un enlace sigma exitoso requiere tener en cuenta diversos factores, como la elección adecuada de los átomos, la hibridación correcta, la orientación adecuada, las cargas formales equilibradas y la práctica constante. Evitar estos errores comunes mejorará significativamente la capacidad de dominar la formación de enlaces sigma y, en última instancia, la química orgánica en general.
Cuál es el proceso paso a paso para formar un enlace sigma correctamente
El enlace sigma es un tipo de enlace químico que se forma cuando los orbitales híbridos de dos átomos se superponen y comparten electrones. Es fundamental comprender cómo se forma este enlace para tener un dominio sólido de la química orgánica.
A continuación, te presentaré un proceso paso a paso para formar un enlace sigma correctamente:
Paso 1: Identificar los átomos involucrados
El primer paso es identificar los átomos que participarán en la formación del enlace sigma. Por lo general, estos átomos son del mismo elemento o están cerca uno del otro en la tabla periódica.
Paso 2: Determinar los orbitales híbridos
A continuación, debemos determinar los orbitales híbridos de los átomos que se unirán. Los orbitales híbridos son combinaciones de los orbitales atómicos originales y nos ayudan a visualizar la geometría molecular.
Existen diferentes tipos de hibridación, como sp, sp2 y sp3, dependiendo del número de orbitales involucrados en la hibridación.
Paso 3: Superposición de los orbitales híbridos
Una vez que hemos determinado los orbitales híbridos, el siguiente paso es superponerlos. Esto implica alinear los orbitales híbridos de los átomos que se unirán de manera que puedan solaparse y compartir electrones.
En el caso de los enlaces sigma, los orbitales híbridos sp3 de los átomos se superponen, lo que permite una mayor estabilidad en la molécula.
Paso 4: Compartir electrones y formar el enlace
Después de la superposición de los orbitales híbridos, los electrones pueden compartirse entre los átomos. Esto implica que los electrones se muevan hacia los orbitales compartidos entre los dos átomos. Los electrones se atraen mutuamente, creando así un enlace sigma fuerte y estable.
Paso 5: Verificar la formación del enlace sigma
Finalmente, es importante verificar si el enlace sigma se ha formado correctamente. Esto se puede hacer analizando la estructura molecular resultante y comprobando las propiedades físicas y químicas de la sustancia.
Al seguir estos cinco simples pasos, puedes dominar la formación del enlace sigma y tener un mejor entendimiento de la química orgánica.
Recuerda practicar y familiarizarte con diferentes ejemplos y casos para fortalecer tu comprensión y habilidades en la formación de enlaces sigma.
Preguntas frecuentes (FAQ)
1. ¿Qué es un enlace sigma?
Un enlace sigma es un tipo de enlace químico que se forma por la superposición y solapamiento de dos orbitales atómicos.
2. ¿Cuál es la diferencia entre un enlace sigma y un enlace pi?
La principal diferencia entre un enlace sigma y un enlace pi es el tipo de solapamiento orbital. En un enlace sigma, los orbitales se solapan directamente a lo largo del eje de la molécula, mientras que en un enlace pi los orbitales se solapan lateralmente.
3. ¿Cuántos enlaces sigma puede haber en una molécula?
El número de enlaces sigma en una molécula depende de su estructura y compuestos específicos. En general, los átomos de carbono pueden formar hasta cuatro enlaces sigma, mientras que otros átomos pueden formar menos o más enlaces sigma dependiendo de su electronegatividad y hibridación.
4. ¿Cómo se forma un enlace sigma?
Un enlace sigma se forma cuando los orbitales atómicos de dos átomos se superponen entre sí y se combinan para formar un nuevo orbital molecular. Esto ocurre mediante una superposición frontal de los orbitales.
5. ¿Cuáles son las principales características de un enlace sigma?
Un enlace sigma es un enlace fuerte y estable que permite el movimiento y la rotación de los átomos unidos. Además, los enlaces sigma son más fuertes que los enlaces pi y son la base de la química orgánica debido a su presencia en los compuestos carbonados.

Entradas relacionadas