Descubre cómo se forman los enlaces metálicos y deslúmbrate con su fascinante estructura
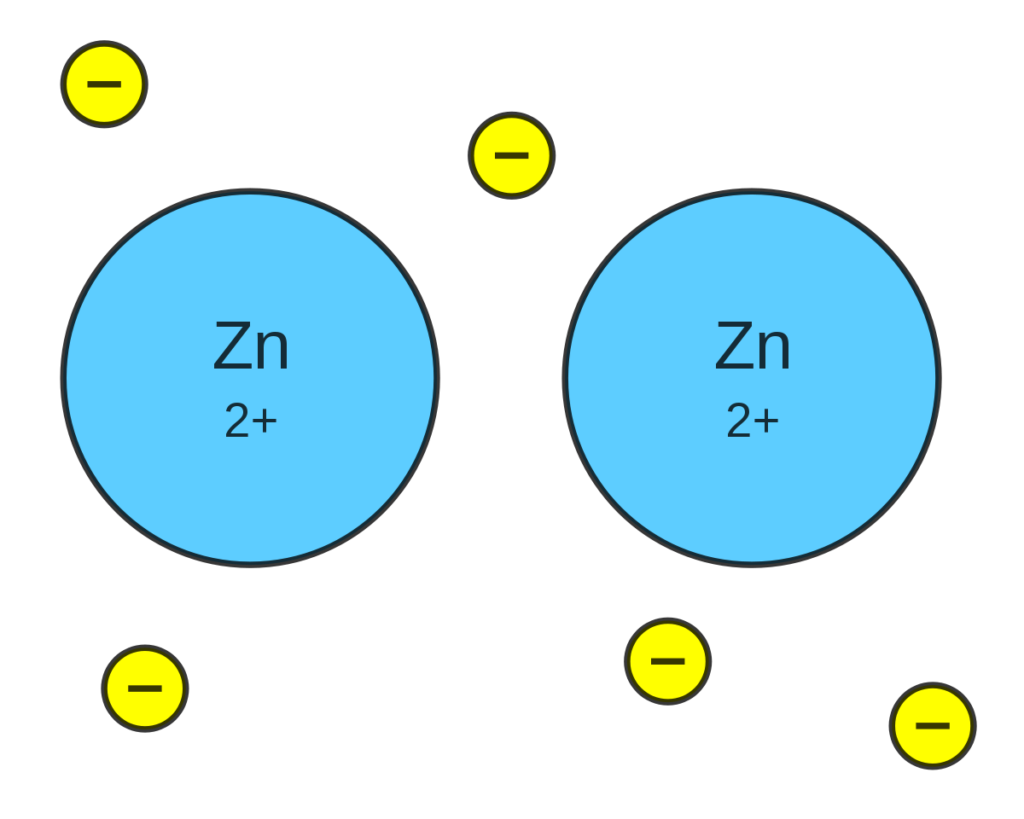
Los metales son elementos químicos que se caracterizan por ser buenos conductores de electricidad y calor, tener una alta densidad y ser sólidos a temperatura ambiente. Estas propiedades se deben principalmente a la forma en que están unidos sus átomos en una estructura sólida, conocida como enlace metálico.
Exploraremos cómo se forman los enlaces metálicos y cómo influye esto en las propiedades físicas y químicas de los metales. Además, analizaremos la estructura de los cristales metálicos y veremos cómo su organización atómica da lugar a la maleabilidad, la ductilidad y otras características específicas de los metales.
- Qué son los enlaces metálicos y cómo se forman
- Cuál es la estructura básica de los enlaces metálicos
- Por qué los metales pueden ser tan conductores eléctricos
- Cuál es el efecto de los enlaces metálicos en las propiedades físicas de los metales
- Cómo contribuyen los electrones del mar a la fortaleza de los enlaces metálicos
- Cuál es la relación entre los enlaces metálicos y la maleabilidad de los metales
- Por qué algunos metales son más duros y más fuertes que otros
- Cómo se utilizan los enlaces metálicos en diversas aplicaciones industriales
- Cuáles son las ventajas y desventajas de los enlaces metálicos en comparación con otros tipos de enlaces químicos
- Existen compuestos que contienen enlaces metálicos más allá de los metales puros
- Preguntas frecuentes (FAQ)
Qué son los enlaces metálicos y cómo se forman
Los enlaces metálicos son un tipo de enlace químico que se forma entre átomos metálicos. A diferencia de los enlaces covalentes y iónicos, los enlaces metálicos no implican una transferencia completa de electrones ni una compartición total de ellos. En su lugar, los electrones de valencia de los átomos metálicos se distribuyen de manera uniforme entre todos los átomos del metal.
Estructura de los enlaces metálicos
La estructura de los enlaces metálicos es lo que les confiere sus propiedades únicas. Los metales están compuestos por una red tridimensional de cationes metálicos inmersos en una "nube" de electrones de valencia móviles. Esta estructura es responsable de características como la conductividad eléctrica y térmica, la maleabilidad y la ductilidad de los metales.
Formación de los enlaces metálicos
La formación de enlaces metálicos ocurre debido a la atracción electrostática entre los cationes metálicos y los electrones de valencia móviles. Cuando varios átomos metálicos se acercan entre sí, los electrones de valencia se deslocalizan en la nube electrónica compartida, formando así un enlace metálico.
Este fenómeno se debe a la gran movilidad de los electrones de valencia en los metales. Los electrones están débilmente ligados a los núcleos atómicos y pueden moverse libremente a través de la estructura metálica, permitiendo que los enlaces metálicos se formen y contribuyendo a las propiedades características de los metales.
Propiedades de los enlaces metálicos
- Conductividad eléctrica: Debido a la presencia de electrones libres, los metales son excelentes conductores de electricidad. Los electrones se mueven fácilmente a lo largo de la estructura metálica, permitiendo que la corriente eléctrica fluya con facilidad.
- Conductividad térmica: La movilidad de los electrones en los enlaces metálicos también conduce a una alta conductividad térmica. Los electrones pueden transferir energía térmica rápidamente a través del material, lo que explica por qué los metales tienden a ser buenos conductores de calor.
- Maleabilidad: Los enlaces metálicos permiten que los metales se deformen sin romperse. Los electrones móviles facilitan el movimiento de los átomos metálicos unos sobre otros, lo que confiere la maleabilidad típica de los metales.
- Ductilidad: Al igual que la maleabilidad, la ductilidad es otra propiedad característica de los metales debido a sus enlaces metálicos. Los átomos metálicos pueden ser estirados en alambres delgados sin romperse debido a la facilidad de movimiento de los electrones de valencia.
Ejemplos de enlaces metálicos
Algunos ejemplos comunes de materiales con enlaces metálicos incluyen el hierro, el aluminio, el cobre, el oro y la plata. Estos metales exhiben las propiedades mencionadas anteriormente debido a la presencia de enlaces metálicos en sus estructuras.
En resumen
Los enlaces metálicos son una forma de enlace químico que se caracteriza por la distribución uniforme de electrones de valencia en una red tridimensional de cationes metálicos. Estos enlaces confieren a los metales propiedades únicas como la conductividad eléctrica y térmica, la maleabilidad y la ductilidad. Algunos ejemplos de materiales con enlaces metálicos son el hierro, el aluminio, el cobre, el oro y la plata.
Cuál es la estructura básica de los enlaces metálicos
Los enlaces metálicos son una forma de unión entre átomos que ocurre en los metales. Estos enlaces son responsables de las propiedades físicas y químicas únicas que presentan los materiales metálicos.
En la estructura básica de los enlaces metálicos, los átomos metálicos forman una red tridimensional o cristalina. Cada átomo metálico contribuye con uno o más electrones a una "nube" de electrones que se extiende por todo el cristal. Esta nube de electrones móviles se conoce como "mar de electrones".
El mar de electrones es responsable de algunas de las características más asombrosas de los metales, como su brillo y alta conductividad eléctrica y térmica. Debido a que los electrones se pueden mover libremente a través del cristal metálico, se puede generar fácilmente corriente eléctrica y transferir calor de manera eficiente.
Cómo se forman los enlaces metálicos
La formación de los enlaces metálicos implica la liberación de electrones de valencia de los átomos individuales. Los átomos metálicos tienen pocos electrones en su nivel de energía más externo, lo que los hace altamente deseables para formar enlaces metálicos.
Algunos elementos metálicos tienden a perder electrones más fácilmente que otros debido a su configuración electrónica. Los átomos metálicos que pierden electrones se convierten en cationes positivos, mientras que los electrones liberados se incorporan al mar de electrones.
Esta atracción entre los cationes positivos y la nube de electrones resulta en un equilibrio electrostático que mantiene unida la red cristalina. Los enlaces metálicos son fuertes debido a esta fuerza de atracción entre los iones y el mar de electrones.
Propiedades fascinantes de los enlaces metálicos
Brillo:Los metales tienen un brillo característico debido a la capacidad del mar de electrones para reflejar la luz incidente.Conductividad eléctrica:Los enlaces metálicos permiten una fácil transferencia de electrones, lo que les confiere alta conductividad eléctrica.Conductividad térmica:Debido a que los electrones pueden moverse libremente en los enlaces metálicos, también se puede transferir calor de manera eficiente, lo que les da una alta conductividad térmica.Maleabilidad y ductilidad:Los enlaces metálicos permiten que los metales se deformen sin romperse, lo que les confiere su capacidad para ser martillados en láminas delgadas (maleabilidad) o estirados en alambres (ductilidad).Punto de fusión y ebullición elevados:Los enlaces metálicos son fuertes, lo que implica que los metales tienen altos puntos de fusión y ebullición.
Los enlaces metálicos son responsables de las propiedades fascinantes que presentan los metales. Su estructura básica, con el mar de electrones y la nube de cationes positivos, les confiere brillo, alta conductividad eléctrica y térmica, maleabilidad, ductilidad y puntos de fusión y ebullición elevados.
Por qué los metales pueden ser tan conductores eléctricos
La capacidad de los metales para conducir electricidad se debe a su fascinante estructura atómica y la forma en que los electrones se distribuyen en ella. A diferencia de otros materiales, como los no metales, los átomos de los metales tienen pocos electrones en su capa de valencia, lo que les confiere propiedades únicas.
En un enlace metálico, los átomos metálicos comparten sus electrones de valencia de manera muy especial. En lugar de formar enlaces covalentes o iónicos típicos, los electrones de valencia en los metales son libres de moverse por toda la estructura metálica. Esto se debe a que los átomos metálicos tienden a perder fácilmente sus electrones de valencia, creando iones positivos, o cationes. Estos cationes se agrupan en una red cristalina tridimensional y los electrones de valencia se mueven entre ellos sin estar ligados a un átomo en particular.
Es esta movilidad de los electrones lo que permite que los metales conduzcan electricidad tan eficientemente. Cuando una fuerza eléctrica externa se aplica a un metal, los electrones pueden moverse libremente a través de la estructura metálica, creando un flujo de corriente eléctrica. Debido a que no están restringidos a un solo átomo, los electrones pueden moverse rápidamente a través del material sin encontrar muchos obstáculos.
Otra característica interesante de los enlaces metálicos es su alta conductividad térmica. Al igual que con la electricidad, los electrones también pueden moverse libremente en respuesta a cambios de temperatura. Esto permite que los metales conduzcan el calor de manera muy eficiente, lo que los hace ideales para aplicaciones donde se requiere una transferencia rápida de calor, como en los disipadores de calor de los equipos electrónicos.
La capacidad de los metales para conducir electricidad y calor se debe a su estructura atómica peculiar, en la cual los electrones de valencia pueden moverse libremente entre los cationes. Esta movilidad de los electrones les confiere propiedades únicas que los convierten en excelentes conductores eléctricos y térmicos. Así, los enlaces metálicos son una de las bases fundamentales de la tecnología moderna y están presentes en una amplia variedad de productos y aplicaciones cotidianas.
Cuál es el efecto de los enlaces metálicos en las propiedades físicas de los metales
Los enlaces metálicos son una forma de unión entre los átomos de los metales que da lugar a la formación de estructuras sólidas. Estos enlaces se caracterizan por ser fuertes, delgados y flexibles, lo que otorga a los metales propiedades físicas únicas y asombrosas.
El efecto de los enlaces metálicos en las propiedades físicas de los metales es significativo. En primer lugar, este tipo de enlace determina la conductividad eléctrica y térmica de los metales. Los electrones de valencia de los átomos metálicos se deslocalizan a lo largo de la estructura cristalina, formando una "nube" de electrones móviles. Esta nube de electrones es responsable de la alta conductividad eléctrica de los metales, ya que puede moverse libremente entre los átomos. Además, estos electrones también son capaces de transportar calor de manera eficiente, lo que explica la alta conductividad térmica de los metales.
Otra propiedad física influenciada por los enlaces metálicos es la maleabilidad de los metales. Debido a la disposición regular de los átomos en la estructura metálica, los metales son capaces de deformarse bajo la acción de una fuerza externa sin romperse. Los electrones móviles permiten que los átomos metálicos se deslicen unos sobre otros con facilidad, lo que resulta en la capacidad de los metales para ser moldeados en láminas delgadas o estirados en alambres.
Además, los enlaces metálicos también influyen en la ductilidad de los metales. La ductilidad es la capacidad de un material para deformarse plásticamente y ser estirado en alambres o hilos finos sin romperse. Este comportamiento se debe nuevamente a la movilidad de los electrones de valencia en los enlaces metálicos, que permite que los átomos metálicos se desplacen y cambien de posición con facilidad.
La resistencia mecánica de los metales también está influenciada por los enlaces metálicos. Aunque los enlaces metálicos son fuertes, su naturaleza flexible hace que los metales sean algo menos rígidos que otros materiales como las cerámicas. Esta flexibilidad les confiere la capacidad de soportar grandes tensiones antes de fracturarse, lo que los convierte en materiales ideales para aplicaciones que requieren resistencia estructural, como la construcción de puentes o edificios.
Los enlaces metálicos tienen un gran impacto en las propiedades físicas de los metales. Desde su alta conductividad eléctrica y térmica hasta su maleabilidad, ductilidad y resistencia mecánica, los enlaces metálicos juegan un papel fundamental en el comportamiento y la versatilidad de los metales. Su fascinante estructura y propiedades hacen de los metales elementos indispensables en numerosas aplicaciones tecnológicas e industriales.
Cómo contribuyen los electrones del mar a la fortaleza de los enlaces metálicos
Los enlaces metálicos son uno de los tipos más comunes de enlaces químicos presentes en diferentes materiales. Son responsables de proporcionar resistencia, conductividad eléctrica y térmica a los metales. Pero, ¿cómo se forman estos enlaces metálicos y qué los hace tan fuertes?
La formación de los enlaces metálicos está estrechamente relacionada con la estructura electrónica de los átomos de los metales. Los metales tienen pocos electrones de valencia y tienden a liberarlos para formar electrones del mar. Estos electrones del mar son una nube de electrones deslocalizados que rodea los átomos metálicos.
Esta nube de electrones del mar es la responsable de las propiedades características de los metales, como su brillo, maleabilidad y conductividad. Los electrones del mar pueden moverse libremente a través de toda la red metálica sin estar ligados a ningún átomo en particular. Esta movilidad electrónica da lugar a la alta conductividad eléctrica y térmica de los metales.
En cuanto a la fortaleza de los enlaces metálicos, esta radica en la atracción electrostática entre los cationes metálicos y los electrones del mar. Los cationes son los átomos de metal que han perdido electrones para formar iones positivos. Los electrones del mar están distribuidos de manera uniforme a lo largo de toda la red metálica y son atraídos por los cationes positivamente cargados.
Como resultado de esta atracción electrostática, los electrones del mar se mantienen en constante movimiento, rodeando los cationes y neutralizando su carga positiva. Esta nube de electrones contribuye a la cohesión de la red metálica y proporciona la resistencia característica de los metales.
Es importante destacar que la estructura de los enlaces metálicos permite la existencia de defectos puntuales en la red metálica. Estos defectos, como las vacantes y las dislocaciones, pueden ser responsables de las propiedades mecánicas particulares de algunos metales, como su ductilidad y maleabilidad.
Los enlaces metálicos se forman gracias a la liberación de electrones por parte de los átomos de metal, dando lugar a una nube de electrones del mar que rodea los cationes metálicos. La atracción electrostática entre los cationes y los electrones del mar proporciona la fortaleza característica de los enlaces metálicos.
Cuál es la relación entre los enlaces metálicos y la maleabilidad de los metales
Los enlaces metálicos son fundamentales para comprender la maleabilidad de los metales. Esta propiedad única de los metales se debe a la forma en que los átomos están dispuestos y unidos entre sí en una red cristalina. Los enlaces metálicos permiten que los átomos compartan sus electrones de valencia con otros átomos, formando lo que se conoce como "mar de electrones".
El mar de electrones es un concepto crucial en la estructura de los metales. Los electrones de valencia de los átomos metálicos son móviles y no están firmemente ligados a un átomo en particular. En su lugar, se desplazan libremente entre los átomos adyacentes, creando una nube de electrones delimitada por la red cristalina.
Esta disposición única de los electrones permite que los metales sean maleables. Cuando se aplica una fuerza externa, las capas de átomos en el material metálico pueden deslizarse unas sobre otras sin romperse el enlace metálico. Esto se debe a la capacidad de los electrones libres para moverse rápidamente y reorganizarse en la dirección de la fuerza aplicada.
La maleabilidad de los metales también está relacionada con la estructura cristalina de estos materiales. Los metales suelen tener una estructura cristalina cúbica, donde los átomos están dispuestos en una red regular repetitiva. Esta estructura proporciona puntos de anclaje sólidos para los átomos y contribuye a la resistencia y la estabilidad del material metálico.
Los enlaces metálicos son esenciales para comprender la maleabilidad de los metales. La capacidad de los electrones de valencia para moverse libremente crea un mar de electrones que permite la deformación del material sin romper los enlaces metálicos. Esta característica se ve reforzada por la estructura cristalina del metal, que proporciona puntos de anclaje sólidos. La combinación de estos factores da como resultado la fascinante y única propiedad de la maleabilidad en los metales.
Por qué algunos metales son más duros y más fuertes que otros
Los enlaces metálicos son fundamentales para comprender por qué algunos metales son más duros y más fuertes que otros. La estructura interna de los metales está compuesta por una red tridimensional de átomos, que forman una matriz sólida muy compacta. Esta estructura ordenada proporciona características únicas a los metales, como su alta conductividad eléctrica y térmica, su brillo característico y su capacidad para soportar altas cargas sin fracturarse.
La formación de los enlaces metálicos ocurre cuando los átomos metálicos se unen entre sí mediante la compartición de electrones. A diferencia de los enlaces covalentes o iónicos, donde los electrones son transferidos o compartidos entre átomos diferentes, en los enlaces metálicos los electrones no están localizados en enlaces específicos, sino que se mueven libremente a través de la estructura metálica.
Esta característica única de los enlaces metálicos es lo que les confiere las propiedades deseables de dureza y resistencia. Los electrones libres pueden moverse fácilmente dentro de la estructura metálica, permitiendo que los metales sean buenos conductores de electricidad. Además, esta movilidad electrónica también contribuye a la capacidad de los metales para deformarse plásticamente bajo cargas externas sin romperse.
La estructura cristalina de los metales es otro aspecto importante a considerar. Los metales suelen tener una estructura cristalina donde los átomos están dispuestos en patrones repetitivos y ordenados en forma de celdas unitarias. Estas celdas unitarias, generalmente en forma de cubo, se repiten a lo largo de todo el metal. Esta estructura cristalina confiere a los metales su fortaleza y rigidez.
Existen diferentes tipos de estructuras cristalinas en los metales, como la cúbica centrada en el cuerpo, la cúbica centrada en las caras o la hexagonal compacta. Cada tipo de estructura cristalina tiene un efecto directo en las propiedades mecánicas del metal, como su dureza, resistencia y maleabilidad. La disposición ordenada de los átomos dentro de estas estructuras permite que los enlaces metálicos sean más fuertes y más resistentes ante esfuerzos externos.
Además de los enlaces metálicos, otros factores también influyen en las propiedades de los metales, como la presencia de aleaciones. Las aleaciones son mezclas sólidas de diferentes metales o metales con otros elementos, que modifican la estructura y las propiedades de los metales puros. Al añadir otro metal o elemento a la matriz de la estructura metálica, se pueden obtener distintos efectos en la dureza, resistencia y otras características del metal resultante.
Los enlaces metálicos juegan un papel fundamental en la formación de la estructura y las propiedades de los metales. Su característica de tener electrones libres en movimiento y una estructura cristalina ordenada les confiere dureza, resistencia y otras propiedades deseables. Comprender cómo se forman los enlaces metálicos nos ayuda a apreciar la fascinante estructura de los metales y las aplicaciones prácticas que tienen en nuestra vida diaria.
Cómo se utilizan los enlaces metálicos en diversas aplicaciones industriales
Los enlaces metálicos son esenciales en numerosas aplicaciones industriales debido a su resistencia, durabilidad y conductividad eléctrica excepcional. Estos enlaces se forman entre los átomos de diferentes metales, lo que resulta en una estructura sólida y coherente.
Una de las principales ventajas de los enlaces metálicos es su capacidad para soportar altas temperaturas sin perder su integridad estructural. Esto los hace ideales para su uso en la fabricación de motores de aviones, turbinas eólicas y otros equipos que están expuestos a condiciones ambientales extremas.
Además de su alta resistencia térmica, los enlaces metálicos también exhiben una excelente conductividad eléctrica. Esta característica es crucial en aplicaciones como los cables eléctricos, donde se requiere una transmisión eficiente de la corriente eléctrica.
Estructura de los enlaces metálicos
La estructura de los enlaces metálicos es única y fascinante. En un enlace metálico, los átomos individuales se organizan en una red tridimensional llamada "red cristalina". Cada átomo metálico comparte sus electrones con los átomos vecinos en la red, creando así un mar de electrones móviles.
Esta "nube" de electrones se puede mover libremente a través de la red cristalina, lo que confiere a los metales su alta conductividad eléctrica y térmica. Además, esta disposición de electrones libres también permite que los metales sean fáciles de trabajar y moldear mediante técnicas como la forja o la extrusión.
Además de la red cristalina, los átomos en un enlace metálico también pueden formar estructuras secundarias llamadas "defectos de dislocación". Estos defectos son áreas donde los átomos están desalineados, lo que puede resultar en propiedades mecánicas únicas del material. Por ejemplo, las dislocaciones pueden hacer que un metal sea más resistente a la deformación bajo tensión.
Aplicaciones industriales de los enlaces metálicos
Los enlaces metálicos se utilizan ampliamente en una variedad de aplicaciones industriales. Una de las aplicaciones más comunes es la fabricación de estructuras metálicas para la construcción de edificios, puentes y otras infraestructuras. La alta resistencia y durabilidad de los enlaces metálicos los hacen ideales para soportar cargas pesadas y condiciones climáticas adversas durante largos períodos de tiempo.
Además de la construcción, los enlaces metálicos también son fundamentales en la industria automotriz. Los metales se utilizan en la fabricación de carrocerías, chasis y componentes del motor para proporcionar resistencia y protección contra impactos. Además, los enlaces metálicos permiten una transferencia eficiente de calor, lo que contribuye al rendimiento térmico de los motores y sistemas de escape.
Otra aplicación importante de los enlaces metálicos se encuentra en la electrónica. Los dispositivos electrónicos como teléfonos móviles, computadoras y tablets contienen componentes metálicos que proporcionan conexiones eléctricas confiables y duraderas.
Los enlaces metálicos desempeñan un papel crucial en diversas aplicaciones industriales debido a su resistencia, durabilidad y conductividad excepcionales. Su estructura única, basada en redes cristalinas y defectos de dislocación, permite una amplia gama de propiedades mecánicas y eléctricas. Estos enlaces son fundamentales en la construcción, la industria automotriz, la electrónica y muchas otras áreas, facilitando el desarrollo de tecnologías avanzadas y mejorando nuestra calidad de vida.
Cuáles son las ventajas y desventajas de los enlaces metálicos en comparación con otros tipos de enlaces químicos
Los enlaces metálicos son una forma única de unión química que se forma entre átomos de metales. Estos enlaces tienen características distintivas y propiedades únicas que los diferencian de otros tipos de enlaces químicos, como los enlaces iónicos o covalentes.
Ventajas de los enlaces metálicos
Una de las principales ventajas de los enlaces metálicos es su capacidad para conducir electricidad y calor de manera eficiente. Esto se debe a la estructura de los metales, donde los electrones de valencia están "delocalizados" y se mueven libremente a través del material. Esta movilidad electrónica permite que los metales sean excelentes conductores eléctricos y térmicos.
Otra ventaja importante de los enlaces metálicos es su maleabilidad y ductilidad. Los metales pueden ser martillados en láminas muy delgadas (maleabilidad) y estirados en alambres largos y finos (ductilidad) sin romperse ni perder su integridad estructural. Esta propiedad se debe a la capacidad de los electrones libres para moverse fácilmente dentro del material y reorganizarse en respuesta a fuerzas externas.
Además, los enlaces metálicos también ofrecen resistencia mecánica. Debido a la naturaleza compacta y ordenada de su estructura cristalina, los metales son capaces de soportar altas tensiones y presiones sin deformarse permanentemente o fracturarse. Esta resistencia mecánica hace que los metales sean ideales para aplicaciones estructurales, como construcción de puentes, edificios y maquinarias.
Desventajas de los enlaces metálicos
A pesar de las numerosas ventajas de los enlaces metálicos, también presentan algunas desventajas. Una desventaja es su alta reactividad en presencia de ciertos agentes químicos o ambientes corrosivos. Los metales pueden oxidarse o corroerse fácilmente cuando se exponen al oxígeno, la humedad o sustancias químicas agresivas. Esto puede comprometer la integridad y durabilidad de los materiales metálicos.
Otra desventaja de los enlaces metálicos es su conductividad eléctrica variable. Aunque los metales son excelentes conductores eléctricos en estado sólido, su capacidad para conducir electricidad puede verse afectada por la presencia de impurezas o aleaciones. Estas impurezas pueden alterar la movilidad electrónica dentro del material y reducir su conductividad eléctrica.
Además, los enlaces metálicos tienden a tener puntos de fusión relativamente altos. Esto significa que los metales requieren temperaturas elevadas para cambiar del estado sólido al líquido. Esta alta temperatura de fusión puede dificultar el procesamiento y moldeado de los metales, especialmente en comparación con otros materiales que tienen puntos de fusión más bajos.
Los enlaces metálicos presentan numerosas ventajas, como su excelente conductividad eléctrica y térmica, maleabilidad, ductilidad y resistencia mecánica. A pesar de estas desventajas, los enlaces metálicos siguen siendo ampliamente utilizados en una amplia variedad de aplicaciones industriales y tecnológicas debido a sus propiedades únicas y fascinante estructura.
Existen compuestos que contienen enlaces metálicos más allá de los metales puros
Los enlaces metálicos son una forma única de unión química que se produce entre los átomos de los metales. Estos enlaces son responsables de muchas de las propiedades características de los metales, como su conductividad eléctrica y térmica, su brillo y su maleabilidad.
La formación de los enlaces metálicos ocurre cuando los átomos metálicos se juntan para formar una red tridimensional, conocida como una estructura cristalina. En esta estructura, los átomos de metal están rodeados por un "mar" de electrones, que se mueven libremente a través del material.
Esta particularidad de los enlaces metálicos es lo que les confiere su alta conductividad, ya que los electrones libres pueden moverse fácilmente a través del material, transportando la corriente eléctrica o el calor de manera eficiente.
Es importante destacar que no solo los metales puros pueden formar enlaces metálicos. También existen compuestos en los que participan átomos metálicos junto con otros elementos no metálicos. Un ejemplo común de esto son las aleaciones, que son mezclas de dos o más metales en las que se forman enlaces metálicos entre los átomos de los distintos metales.
Estas aleaciones presentan propiedades diferentes a las de los metales puros, ya que la presencia de diferentes átomos puede alterar la estructura de la red cristalina y afectar la movilidad de los electrones libres. Esto puede resultar en cambios en la conductividad, la resistencia mecánica o la resistencia a la corrosión, entre otras propiedades.
La fascinante estructura de los enlaces metálicos es un tema apasionante para los científicos e ingenieros, que continúan explorando nuevas formas de modificar y aprovechar estas propiedades en diversos campos. Desde la creación de materiales más resistentes y livianos en la industria aeroespacial, hasta el desarrollo de dispositivos electrónicos cada vez más eficientes, los enlaces metálicos han demostrado ser fundamentales para el avance tecnológico.
En conclusión
Los enlaces metálicos son una forma especial de unión química que se da entre los átomos de los metales. Estos enlaces tienen lugar en una estructura cristalina en la que los átomos metálicos están rodeados por electrones libres, lo que les confiere propiedades únicas como alta conductividad eléctrica y térmica. Además, también existen compuestos en los que se forman enlaces metálicos entre átomos de diferentes metales, conocidos como aleaciones. La estructura de los enlaces metálicos y sus propiedades han sido objeto de estudio en diversos campos de la ciencia y la ingeniería, ya que su entendimiento y manipulación permiten desarrollar nuevos materiales y tecnologías.
Preguntas frecuentes (FAQ)
1. ¿Qué es un enlace metálico?
Un enlace metálico es una fuerza de atracción electrostática entre los átomos de metales, que resulta en la formación de una estructura tridimensional llamada red metálica.
2. ¿Cuál es la característica principal de los enlaces metálicos?
La característica principal de los enlaces metálicos es que los electrones de valencia se deslocalizan y se mueven libremente entre los átomos del metal, creando así una nube electrónica que confiere las propiedades metálicas, como la conductividad eléctrica y térmica.
3. ¿Cómo se forman los enlaces metálicos?
Los enlaces metálicos se forman a través de la fusión de átomos metálicos que comparten sus electrones de valencia, generando una red tridimensional de cationes metálicos rodeados por una nube de electrones.
4. ¿Qué determina la resistencia de un metal?
La resistencia de un metal está determinada por la cantidad de electrones libres y la eficiencia con la que estos pueden moverse dentro de la red metálica. Cuantos más electrones libres y mayor movilidad tengan, mayor será la conductividad y la resistencia del metal.
5. ¿Por qué los metales son buenos conductores de electricidad y calor?
Los metales son buenos conductores de electricidad y calor debido a la presencia de la nube de electrones deslocalizados en la estructura metálica. Estos electrones pueden moverse fácilmente bajo la influencia de un campo eléctrico o térmico, permitiendo el transporte de carga eléctrica y energía térmica a través del material.
Deja una respuesta
Entradas relacionadas