El Elemento Más Electronegativo: Descubre la Clave para Entender las Reacciones Químicas
En el fascinante mundo de la química, la electronegatividad juega un papel fundamental. Se trata de una propiedad de los elementos químicos que determina su capacidad para atraer electrones en una molécula. En otras palabras, nos indica qué tan fuertemente un átomo atrae los electrones que comparte con otros átomos en un enlace químico. La electronegatividad es clave para entender y predecir las reacciones químicas, ya que determina cómo se comparten o transfieren los electrones entre los átomos.
Exploraremos en detalle el concepto de electronegatividad y su importancia en las reacciones químicas. Comenzaremos por definir qué es la electronegatividad y cómo se calcula. Luego, analizaremos el elemento más electronegativo de la tabla periódica y discutiremos su influencia en las propiedades químicas de los compuestos. Además, veremos ejemplos de cómo la electronegatividad afecta la polaridad de las moléculas y cómo esto permite predecir su comportamiento químico. Al final, comprenderás la importancia del elemento más electronegativo y cómo su presencia puede determinar la reactividad de distintas sustancias.
- Qué es la electronegatividad y por qué es importante en las reacciones químicas
- Cuál es el elemento más electronegativo y cómo se determina
- Qué propiedades químicas tienen los elementos altamente electronegativos
- Cuáles son algunos ejemplos de reacciones químicas donde la electronegatividad desempeña un papel importante
- Cómo afecta la diferencia de electronegatividad entre dos átomos a la formación de enlaces químicos
- En qué medida influye la electronegatividad en la polaridad de las moléculas
- Cuál es la relación entre la electronegatividad y la solubilidad de una sustancia en agua
- Cómo se relaciona la electronegatividad con la acidez o basicidad de una sustancia
- Cuál es la importancia de conocer la electronegatividad en la predicción de reacciones químicas
- Existen excepciones a la tendencia general de la electronegatividad en la tabla periódica
Qué es la electronegatividad y por qué es importante en las reacciones químicas
La electronegatividad es una propiedad química que determina la atracción que tiene un átomo por los electrones en una molécula. Es decir, indica la capacidad de un átomo para atraer y retener electrones compartidos en una molécula. Esta propiedad fundamental es crucial para comprender las reacciones químicas, ya que afecta directamente a la forma en que se distribuyen los electrones y la estabilidad de los compuestos.
La electronegatividad se utiliza para predecir la polaridad de los enlaces químicos. Cuando dos átomos se unen, el átomo más electronegativo atraerá con mayor fuerza los electrones compartidos, generando así una carga parcial negativa en su región y una carga parcial positiva en la del átomo menos electronegativo. Esta asimetría en la distribución electrónica crea un enlace polar, lo que significa que hay una separación de cargas en la molécula.
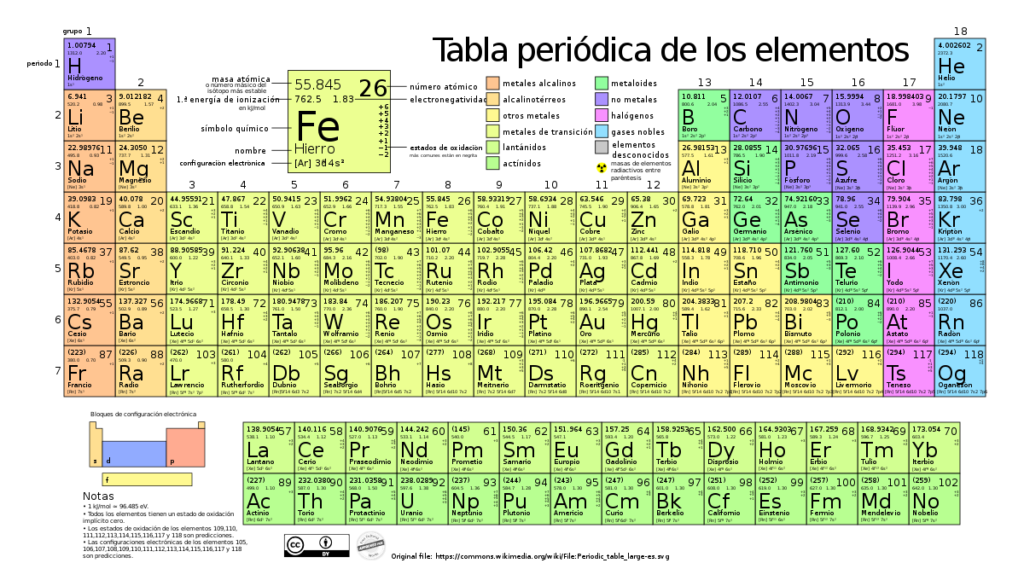
Los elementos más electronegativos son aquellos que se encuentran en la esquina superior derecha de la tabla periódica, como el flúor (F), oxígeno (O) y nitrógeno (N). Estos elementos tienen una alta afinidad por los electrones y tienden a atraerlos con mucha fuerza, lo que los convierte en buenos aceptores de electrones.
¿Cuál es el elemento más electronegativo?
El elemento más electronegativo en la tabla periódica es el flúor, con un valor de electronegatividad de 3.98 en la escala de Pauling. Esta escala, desarrollada por el químico Linus Pauling, asigna valores numéricos a los elementos según su capacidad para atraer electrones en un enlace químico.
El flúor es extremadamente electronegativo debido a su pequeño tamaño y alta carga nuclear efectiva. Su configuración electrónica le permite alcanzar una estructura similar a la del gas noble helio, que tiene una estabilidad y baja energía muy deseables. Por lo tanto, el flúor tiende a aceptar electrones con gran facilidad para completar su octeto y adquirir una configuración estable.
Importancia de la electronegatividad en las reacciones químicas
La electronegatividad desempeña un papel fundamental en las reacciones químicas, ya que determina el comportamiento de los átomos y moléculas durante una transformación química. Al ser capaz de atraer electrones con mayor o menor fuerza, los elementos interactúan de manera diferente y pueden formar distintos tipos de enlaces químicos.
Una alta electronegatividad indica una fuerte atracción por los electrones, lo que hace que un átomo sea más propenso a ganar electrones (oxidarse) o compartirlos de manera asimétrica en una molécula. Esto se ve especialmente en los elementos no metálicos, donde la diferencia de electronegatividad entre ellos puede dar lugar a enlaces covalentes polares o incluso iónicos.
Por otro lado, los elementos menos electronegativos tienen una menor atracción por los electrones y tienden a perder electrones (reducirse) en las reacciones químicas. Estos elementos son típicamente los metales, que tienen baja electronegatividad y tienden a formar cationes al perder sus electrones de valencia. Esto permite la formación de enlaces iónicos con elementos altamente electronegativos.
La electronegatividad también es importante para comprender las propiedades físicas y químicas de los compuestos. Por ejemplo, sustancias como el agua (H2O) y el amoníaco (NH3), que contienen átomos altamente electronegativos (oxígeno y nitrógeno), exhiben características polares debido a la distribución asimétrica de cargar generada por la diferencia de electronegatividad.
La electronegatividad es una propiedad clave para entender las reacciones químicas ya que determina la forma en que los átomos interaccionan y se unen entre sí. Desde la formación de enlaces covalentes hasta la polaridad de las moléculas, la electronegatividad juega un papel fundamental en la comprensión de la química y nos ayuda a entender por qué algunos compuestos son más reactivos o estables que otros.
Cuál es el elemento más electronegativo y cómo se determina
El elemento más electronegativo en la tabla periódica es aquel que tiene una mayor atracción por los electrones cuando forma un enlace químico con otro elemento. Esta propiedad se debe a la estructura electrónica del átomo y está determinada por diversos factores, como el número atómico, la carga nuclear efectiva y el tamaño del átomo.
La electronegatividad se utiliza para predecir cómo se compartirán los electrones en un enlace químico y cómo será la distribución de carga en la molécula resultante. Determinar el elemento más electronegativo es fundamental para comprender las reacciones químicas y sus mecanismos.
Existen varios métodos para determinar la electronegatividad de los elementos. Uno de los más utilizados es la escala de Pauling, propuesta por Linus Pauling en 1932. En esta escala, el elemento más electronegativo es el flúor, con un valor de electronegatividad de 3.98, seguido por el oxígeno (3.44) y el cloro (3.16).
La electronegatividad también varía dentro de un mismo grupo o familia de la tabla periódica. Por ejemplo, dentro del grupo de los halógenos, el flúor es el más electronegativo, seguido por el cloro, bromo e iod
Esta variación de electronegatividad se debe principalmente a la disminución del tamaño atómico y al aumento de la carga nuclear efectiva a medida que se desciende en un grupo.
El elemento más electronegativo es aquel que tiene una mayor capacidad para atraer electrones en un enlace químico. La electronegatividad se determina mediante diferentes métodos, como la escala de Pauling, y varía tanto a través de la tabla periódica como dentro de un mismo grupo o familia.
Qué propiedades químicas tienen los elementos altamente electronegativos
Los elementos altamente electronegativos son aquellos que tienen una gran capacidad para atraer electrones cuando forman enlaces químicos con otros átomos. La electronegatividad es una propiedad periódica de los elementos que se basa en su afinidad por los electrones.
Cuando un elemento tiene una alta electronegatividad, significa que tiende a atraer con más fuerza los electrones compartidos en un enlace químico. Esto se debe a que estos elementos tienen una mayor tendencia a ganar electrones y formar iones negativos.
Una de las consecuencias de la alta electronegatividad es que los elementos altamente electronegativos tienden a formar enlaces covalentes polares. Estos enlaces se producen entre átomos de diferentes electronegatividades, lo que crea una distribución desigual de cargas dentro de la molécula. En otras palabras, hay una separación parcial de cargas en la molécula.
Las moléculas con enlaces covalentes polares son polares en sí mismas, lo que significa que tienen un polo positivo y un polo negativo. Esto les confiere propiedades únicas, como la capacidad de disolver sustancias polares y la habilidad de formar puentes de hidrógeno.
Otra propiedad química de los elementos altamente electronegativos es su capacidad para recibir electrones en reacciones de reducción. Estos elementos tienden a actuar como oxidantes, ya que pueden aceptar electrones y reducirse, mientras que otro reactante se oxida al perder electrones.
Además de estas propiedades químicas, los elementos altamente electronegativos también tienen un impacto en las reacciones químicas en general. Debido a su alta afinidad por los electrones, estos elementos pueden influir en la estabilidad de los compuestos formados y en la velocidad de las reacciones.
Los elementos altamente electronegativos son aquellos que tienen una gran capacidad para atraer electrones. Esta propiedad les permite formar enlaces covalentes polares, actuar como oxidantes en reacciones de reducción y afectar la estabilidad y la velocidad de las reacciones químicas.
Cuáles son algunos ejemplos de reacciones químicas donde la electronegatividad desempeña un papel importante
La electronegatividad es una propiedad fundamental de los elementos químicos que desempeña un papel crucial en las reacciones químicas. Es la capacidad de un átomo de atraer los electrones hacia sí mismo cuando forma un enlace químico con otro átomo. En otras palabras, indica cuán fuertemente un átomo puede retener o compartir electrones en una molécula.
Las reacciones químicas son procesos en los cuales los átomos se rearrangan y se forman nuevos compuestos. La electronegatividad juega un papel importante en determinar cómo se llevan a cabo estas reacciones y qué productos se forman. A continuación, exploraremos algunos ejemplos de reacciones químicas en las que la electronegatividad tiene un papel destacado:
1. Reacciones de combustión
La combustión es una reacción química en la que un compuesto reacciona con el oxígeno para generar calor y luz. La electronegatividad del oxígeno es alta, lo que significa que tiene una fuerte atracción por los electrones. En una reacción de combustión, el oxígeno se combina con un combustible, como el carbono o el hidrógeno, para formar dióxido de carbono y agua. Durante esta reacción, el oxígeno atrae los electrones de los átomos de carbono e hidrógeno, generando una liberación de energía en forma de calor y luz.
2. Reacciones de oxidación-reducción
En las reacciones de oxidación-reducción, también conocidas como reacciones redox, ocurren transferencias de electrones entre diferentes especies químicas. La electronegatividad de los elementos involucrados determina si se oxidan o reducen. En una reacción de oxidación, el átomo o molécula pierde electrones, mientras que en una reacción de reducción, el átomo o molécula gana electrones. La electronegatividad relativa de los elementos involucrados permite predecir qué especies químicas son más propensas a oxidarse o reducirse.
3. Reacciones ácido-base
La electronegatividad también juega un papel importante en las reacciones ácido-base. Un ácido es una sustancia que dona protones (H+), mientras que una base es una sustancia que acepta protones. En una reacción ácido-base, el hidrógeno cede su protón al ácido y la base acepta ese protón. La electronegatividad del hidrógeno y los otros elementos en la molécula influencia la fuerza con la que se produce la donación y aceptación de protones.
4. Reacciones de formación de enlaces iónicos
En las reacciones de formación de enlaces iónicos, los electrones son transferidos completamente de un átomo a otro. Los metales, que generalmente tienen baja electronegatividad, tienden a perder electrones y formar cationes. Los no metales, que tienen alta electronegatividad, tienden a ganar electrones y formar aniones. Estos iones de carga opuesta se atraen entre sí y forman enlaces iónicos, como en el caso del cloruro de sodio (NaCl).
La electronegatividad desempeña un papel fundamental en diversas reacciones químicas. Ya sea en las reacciones de combustión, las reacciones de oxidación-reducción, las reacciones ácido-base o las reacciones de formación de enlaces iónicos, la electronegatividad influye en cómo los átomos se comportan y qué productos se forman. Comprender este concepto es clave para tener un conocimiento sólido de la química y cómo se producen las transformaciones químicas en nuestro mundo.
Cómo afecta la diferencia de electronegatividad entre dos átomos a la formación de enlaces químicos
La electronegatividad es una propiedad periódica de los elementos que indica su capacidad para atraer electrones en un enlace químico. Es un factor clave para entender cómo se forman y qué tipo de enlaces pueden establecer los átomos en una molécula.
La diferencia de electronegatividad entre dos átomos determina la polaridad del enlace que forman. Un enlace se considera polar cuando existe una diferencia significativa de electronegatividad entre los átomos que lo conforman, lo que resulta en la formación de polos positivos y negativos en la molécula.
En general, existe una tendencia a que los elementos de mayor electronegatividad estén ubicados en el extremo derecho y superior de la tabla periódica. El flúor, por ejemplo, es el elemento más electronegativo, mientras que el cesio es el menos electronegativo.
Tipos de enlaces químicos según la diferencia de electronegatividad
Cuando la diferencia de electronegatividad entre dos átomos es muy grande, se forma un enlace iónico. Esto significa que uno de los átomos atrae fuertemente los electrones, adquiriendo carga negativa (anión), mientras que el otro átomo pierde electrones, adquiriendo carga positiva (catión). Estos iones opuestos se atraen entre sí mediante fuerzas electrostáticas y forman un compuesto iónico.
Por otro lado, cuando la diferencia de electronegatividad es moderada, se forma un enlace covalente polar. En este tipo de enlace, los átomos comparten electrones de manera desigual, lo que resulta en la formación de polos positivos y negativos en la molécula. El oxígeno y el hidrógeno en una molécula de agua son un ejemplo de enlace covalente polar.
Finalmente, cuando la diferencia de electronegatividad es prácticamente nula, se forma un enlace covalente no polar. En este caso, los átomos comparten los electrones de manera equitativa y no existe una separación significativa de cargas eléctricas en la molécula. El enlace entre dos átomos de carbono en una molécula de metano es un ejemplo de enlace covalente no polar.
Influencia de la electronegatividad en las reacciones químicas
La electronegatividad también influye en la reactividad de los elementos y en la forma en que ocurren las reacciones químicas. Cuando hay una diferencia de electronegatividad entre los átomos de las sustancias que reaccionan, se generan desplazamientos electrónicos que producen la formación o ruptura de enlaces.
Por ejemplo, en una reacción de oxidación-reducción, donde hay transferencia de electrones, el elemento más electronegativo tiende a ganar electrones y reducirse, mientras que el elemento menos electronegativo tiende a perder electrones y oxidarse.
Además, la electronegatividad también juega un papel importante en la solubilidad de las sustancias. Los compuestos iónicos, que están formados por iones positivos y negativos, tienden a ser solubles en solventes polares debido a las interacciones entre estas cargas opuestas. Por otro lado, los compuestos covalentes no polares suelen ser menos solubles en solventes polares, ya que carecen de polos cargados.
La diferencia de electronegatividad entre dos átomos es fundamental para entender cómo se forman los enlaces químicos y cómo ocurren las reacciones químicas. Esta propiedad periódica nos ayuda a predecir la polaridad de los enlaces, el tipo de compuesto que se formará y las propiedades físicas y químicas que presentará.
En qué medida influye la electronegatividad en la polaridad de las moléculas
La electronegatividad es una propiedad fundamental en química que determina la capacidad de un átomo para atraer electrones hacia sí mismo. Esta propiedad influye directamente en la polaridad de las moléculas, lo que a su vez juega un papel clave en las reacciones químicas.
La polaridad de una molécula está determinada por la diferencia de electronegatividades entre los átomos que la componen. Si esta diferencia es grande, se dice que la molécula es polar, mientras que si la diferencia es pequeña o nula, la molécula es no polar.
En el caso de las moléculas polares, los átomos con mayor electronegatividad atraen con más fuerza a los electrones compartidos en los enlaces covalentes, generando una distribución desigual de cargas. Esto da lugar a una separación de cargas parciales positivas y negativas dentro de la molécula.
Estas cargas parciales crean regiones positivas y negativas en la molécula que interactúan con otras moléculas polares o iones, lo que facilita la formación de enlaces intermoleculares o interacciones electrostáticas. Estas interacciones son fundamentales en muchas reacciones químicas, ya que determinan la solubilidad de una molécula en un determinado solvente, la fusión y ebullición de una sustancia, y la formación de diversos compuestos químicos.
Por otro lado, las moléculas no polares tienen una distribución de cargas más uniforme debido a que los átomos que las componen tienen una diferencia de electronegatividad baja o nula. Esto hace que no se genere una separación de cargas, por lo que este tipo de moléculas son menos propensas a formar enlaces intermoleculares o interacciones electrostáticas.
Es importante destacar que existen otros factores que también pueden influir en la polaridad de las moléculas, como la geometría molecular y la presencia de grupos funcionales. Sin embargo, la electronegatividad es uno de los principales determinantes de la polaridad y, por ende, de las propiedades químicas de las moléculas.
La electronegatividad es una propiedad crucial para entender la polaridad de las moléculas y su impacto en las reacciones químicas. A través de la atracción de electrones, los átomos más electronegativos generan una separación de cargas que facilita las interacciones intermoleculares. Comprender esta relación nos permite comprender mejor el comportamiento químico de las sustancias y su implicancia en diversos procesos químicos y biológicos.
Cuál es la relación entre la electronegatividad y la solubilidad de una sustancia en agua
La electronegatividad es una propiedad química fundamental que puede tener un gran impacto en la solubilidad de una sustancia en agua. Para comprender mejor esta relación, es importante entender primero qué es la electronegatividad y cómo se relaciona con las reacciones químicas.
La electronegatividad es una medida de la capacidad de un átomo para atraer electrones hacia sí mismo en un enlace químico. En otras palabras, es una medida de la tendencia de un átomo a atraer los electrones compartidos en un enlace con otro átomo. Los átomos más electronegativos tienden a atraer con mayor fuerza los electrones y, por lo tanto, tienen una mayor capacidad de polarizar el enlace químico.
En cuanto a la solubilidad de una sustancia en agua, esta propiedad depende en gran medida de la polaridad de la molécula. El agua es una molécula polar que tiene una carga parcial positiva en el átomo de hidrógeno y una carga parcial negativa en el átomo de oxígeno. Como resultado, el agua puede interactuar de manera favorable con otras moléculas polares, disolviéndolas eficientemente.
Si consideramos la electronegatividad de una sustancia, podemos inferir su naturaleza polar o no polar. Si la diferencia de electronegatividades entre los átomos que forman la molécula es pequeña, es probable que la sustancia sea no polar y tenga una baja solubilidad en agua. En cambio, si la diferencia de electronegatividades es grande, la sustancia será polar y soluble en agua.
Por ejemplo, el dióxido de carbono (CO2) es una molécula no polar, ya que los átomos de carbono y oxígeno tienen electronegatividades similares. Debido a su naturaleza no polar, el CO2 tiene una baja solubilidad en agua. Esto explica por qué el dióxido de carbono es liberado en forma de gas cuando se agrega a un líquido acuoso.
En contraste, las sustancias iónicas y polares, como la sal de mesa (NaCl) y el azúcar (C12H22O11), son altamente solubles en agua debido a sus diferencias de electronegatividad. En el caso de la sal de mesa, el sodio (Na) tiene una baja electronegatividad en comparación con el cloro (Cl), lo que lleva a la formación de iones positivos y negativos en agua, permitiendo que la sal se disuelva eficientemente. Similarmente, el azúcar se disuelve en agua debido a la presencia de grupos funcionales polares, que interactúan con las cargas parciales del agua.
La electronegatividad desempeña un papel crucial en la solubilidad de una sustancia en agua. Los compuestos con una diferencia de electronegatividad pequeña tienden a ser no polares y tienen una baja solubilidad en agua, mientras que aquellos con una gran diferencia de electronegatividad son polares y solubles en agua. Esta relación es fundamental para entender cómo interactúan las sustancias en las reacciones químicas y cómo afecta su solubilidad.
Cómo se relaciona la electronegatividad con la acidez o basicidad de una sustancia
La importancia de la electronegatividad en la acidez y basicidad de una sustancia
La electronegatividad es una propiedad de los elementos químicos que determina su capacidad para atraer electrones en un enlace químico. Esencialmente, se puede pensar en la electronegatividad como la medida de cuánto un átomo "desea" atraer los electrones compartidos en un enlace químico.
Esta propiedad tiene una gran relevancia cuando se trata de comprender la acidez o basicidad de una sustancia. En general, los elementos con alta electronegatividad tienden a ser ácidos o formar sustancias ácidas, mientras que aquellos con baja electronegatividad tienden a ser básicos o formar sustancias básicas.
La relación entre la electronegatividad y la acidez o basicidad de una sustancia se debe al comportamiento de los átomos y las moléculas en una reacción química. Cuando una sustancia ácida se disuelve en agua, libera iones hidrógeno (H⁺) en solución, los cuales son extremadamente electronegativos debido a su pequeño tamaño y carga positiva.
Estos iones de hidrógeno altamente electronegativos pueden atraer electrones del agua circundante, generando un ambiente con cargas negativas locales. Esto hace que el agua actúe como base y acepte estos iones H⁺, equilibrando parcialmente la carga.
Por otro lado, las sustancias básicas contienen iones hidroxilo (OH⁻), que son menos electronegativos que los iones H⁺. Los iones hidroxilo tienen una carga negativa debido al exceso de electrones, lo que les permite actuar como bases y aceptar protones del agua, generando moléculas de agua anfóteras.
La electronegatividad de los átomos en una sustancia influye directamente en su acidez o basicidad. Los átomos altamente electronegativos tienden a ser ácidos, ya que atraen electrones con mayor facilidad, mientras que aquellos con baja electronegatividad tienden a ser básicos, ya que tienen una menor capacidad para atraer electrones.
Es importante destacar que la electronegatividad no es el único factor que determina la acidez o basicidad de una sustancia, ya que también intervienen otras propiedades como la estabilidad de los productos de reacción, la fuerza del enlace químico y la presencia de grupos funcionales.
Comprender la relación entre la electronegatividad y la acidez o basicidad de una sustancia es fundamental para entender las reacciones químicas. Esta propiedad nos ayuda a predecir cómo se comportarán los diferentes compuestos en una determinada situación y nos brinda información valiosa sobre sus propiedades químicas y físicas.
Cuál es la importancia de conocer la electronegatividad en la predicción de reacciones químicas
La electronegatividad es una propiedad fundamental de los elementos químicos que juega un papel crucial en la predicción de reacciones químicas. Esta propiedad describe la capacidad de un átomo para atraer electrones hacia sí mismo cuando forma un enlace químico con otro átomo. En pocas palabras, cuanto mayor sea la electronegatividad de un elemento, más fuerte será su atracción por los electrones.
En el campo de la química, la electronegatividad se utiliza para predecir cómo se distribuirán los electrones entre los átomos en una molécula o compuesto. Esto tiene consecuencias importantes en la estabilidad y reactividad de las sustancias químicas. Al conocer la electronegatividad de los elementos involucrados en una reacción química, los científicos pueden prever la dirección en la cual se llevará a cabo la transferencia o compartición de electrones.
Una vez que hemos comprendido la importancia de la electronegatividad en las reacciones químicas, podemos comenzar a entender muchas otras propiedades de los elementos y compuestos. Por ejemplo, la diferencia de electronegatividad entre dos elementos puede dar lugar a la formación de enlaces covalentes polar o iónico. En un enlace covalente polar, uno de los átomos atrae más fuertemente los electrones compartidos, generando así una distribución asimétrica de la carga eléctrica. Esto da lugar a polos positivos y negativos en la molécula, lo que afecta la solubilidad, punto de ebullición, punto de fusión y otras características físicas y químicas.
Además, la electronegatividad también tiene implicaciones en la polaridad molecular. Cuando una molécula se compone de átomos que tienen diferentes electronegatividades, se crea una polaridad debido a la distribución asimétrica de los electrones. Por otro lado, si una molécula se forma con átomos iguales o con electronegatividades similares, la molécula será no polar. Esta diferencia es clave para entender el comportamiento de las sustancias en soluciones y reacciones químicas.
Conocer la electronegatividad nos permite predecir cómo se producirán las transferencias de electrones y la formación de enlaces químicos en una reacción. Esto, a su vez, nos ayuda a entender numerosas propiedades físicas y químicas de los compuestos y elementos. Por lo tanto, la electronegatividad se convierte en una herramienta indispensable en el campo de la química, proporcionando una base sólida para la comprensión y el estudio de las reacciones químicas.
Existen excepciones a la tendencia general de la electronegatividad en la tabla periódica
La electronegatividad es una propiedad fundamental de los elementos químicos que determina su capacidad para atraer electrones en una molécula o compuesto. Esta propiedad se basa en el concepto de que algunos átomos tienen una mayor afinidad por los electrones que otros, lo que resulta en la formación de enlaces químicos y reacciones específicas.
Sin embargo, aunque la electronegatividad sigue una tendencia general en la tabla periódica, existen ciertas excepciones a esta regla. Estas excepciones se deben principalmente a la configuración electrónica de los elementos y a las características particulares de los enlaces que pueden formar.
Familias de elementos con alta electronegatividad
En general, los elementos ubicados en las familias de los halógenos (grupo 17) y los gases nobles (grupo 18) tienden a tener una alta electronegatividad. Esto se debe a que los halógenos tienen configuraciones electrónicas cercanas a alcanzar la estabilidad mediante la adquisición de un electrón para completar su último nivel de energía, mientras que los gases nobles tienen una configuración electrónica completa y, por lo tanto, no necesitan ganar o perder electrones.
Por otro lado, algunos elementos de transición, como el oxígeno y el nitrógeno, también presentan una alta electronegatividad debido a su capacidad para formar enlaces covalentes con otros elementos. Al compartir electrones, estos elementos pueden alcanzar la estabilidad electrónica y formar moléculas con diferentes propiedades químicas.
Excepciones a la tendencia general de la electronegatividad
A pesar de la tendencia general, existen algunas excepciones notables en la tabla periódica. Por ejemplo, el francio, que pertenece a la familia de los metales alcalinos (grupo 1), tiene la menor electronegatividad de todos los elementos debido a su gran tamaño y baja afinidad por los electrones.
Otro ejemplo es el carbono, que se encuentra en el grupo 14 de la tabla periódica. Aunque se espera que tenga una electronegatividad moderada debido a su posición, el carbono muestra una alta electronegatividad cuando forma enlaces covalentes con elementos más electronegativos como el oxígeno o el nitrógeno.
La electronegatividad es la propiedad que tienen los átomos de atraer electrones hacia sí mismos en una molécula. Es importante en las reacciones químicas porque determina cómo se distribuyen los electrones en los enlaces y si una molécula será polar o no.
El flúor (F) es el elemento más electronegativo de la tabla periódica.
En un enlace covalente polar, los átomos comparten los electrones de manera desigual debido a las diferencias de electronegatividad. Un átomo tiene una mayor atracción por los electrones, lo que resulta en una carga parcial negativa y otro átomo tiene una carga parcial positiva.
La electronegatividad es la capacidad de un átomo para atraer electrones en una molécula, mientras que la afinidad electrónica es la energía liberada cuando un átomo gana un electrón. La electronegatividad se refiere a átomos en compuestos, mientras que la afinidad electrónica es una medida de átomos aislados.
La electronegatividad determina la distribución de las cargas en una molécula y, por lo tanto, su polaridad. Si hay una gran diferencia de electronegatividad entre los átomos, la molécula será polar. Si la diferencia de electronegatividad es pequeña o inexistente, la molécula será no polar.

Entradas relacionadas