La Ley de Boyle: Todo lo que necesitas saber sobre la relación entre presión y volumen
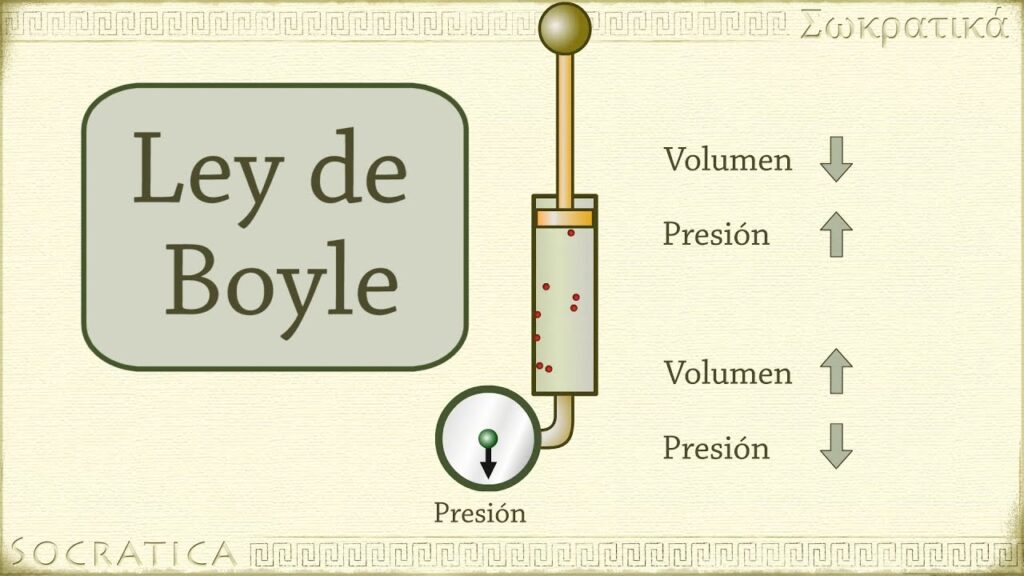
La Ley de Boyle es una ley fundamental en la física, que establece la relación inversa entre la presión y el volumen de un gas a temperatura constante. Fue formulada por Robert Boyle, científico y filósofo inglés, en el siglo VII y sentó las bases de la termodinámica.
Exploraremos en detalle la Ley de Boyle y cómo se aplica en diferentes contextos. Analizaremos los conceptos clave como la presión, el volumen y la temperatura, así como los experimentos y ejemplos que demuestran la validez de esta ley. Además, discutiremos algunas aplicaciones prácticas de la Ley de Boyle en la vida cotidiana y en diversos campos de la ciencia y la ingeniería.
- Qué es la Ley de Boyle y cuál es su importancia en la física
- Cuál es la relación entre presión y volumen según la Ley de Boyle
- Cómo se puede expresar matemáticamente la Ley de Boyle
- Cuáles son algunos ejemplos cotidianos que demuestran la Ley de Boyle
- Qué experimento clásico demostró la validez de la Ley de Boyle
- Cuál es la implicación de la Ley de Boyle en los sistemas de ventilación y compresión de gases
- Cómo se relaciona la Ley de Boyle con los buceadores y el fenómeno de la presión submarina
- Cómo se puede aplicar la Ley de Boyle en la medicina, particularmente en los respiradores artificiales
- Cuáles son las limitaciones y excepciones a la Ley de Boyle
- Cuáles son algunas fuentes adicionales para aprender más sobre la Ley de Boyle
- Preguntas frecuentes (FAQ)
Qué es la Ley de Boyle y cuál es su importancia en la física
La Ley de Boyle, también conocida como la Ley de los gases de Boyle-Mariotte, establece que a temperatura constante, el volumen de un gas es inversamente proporcional a la presión aplicada sobre él. Esto significa que si se aumenta la presión de un gas, su volumen disminuirá, y viceversa.
Esta ley fue formulada por Robert Boyle, un científico irlandés, en el siglo VII. Su descubrimiento revolucionó el campo de la física y sentó las bases para el estudio de los gases.
La importancia de la Ley de Boyle radica en su aplicación en diversos campos de la ciencia y la industria. En física, esta ley es fundamental para comprender el comportamiento de los gases y describir fenómenos como la difusión y el equilibrio termodinámico. Además, tiene aplicaciones prácticas en áreas como la medicina, la ingeniería química y la meteorología.
Principales conceptos relacionados con la Ley de Boyle
Para comprender mejor la Ley de Boyle, es necesario tener claridad sobre algunos conceptos fundamentales:
Presión:Es la fuerza ejercida por unidad de superficie. Se mide en unidades como el Pascal (Pa) o el milímetro de mercurio (mmHg).Volumen:Hace referencia al espacio ocupado por un gas. Se mide en unidades como el litro (L) o el metro cúbico (m³).Temperatura:Es una medida de la energía térmica presente en un sistema. Se mide en grados Celsius (°C) o Kelvin (K).Gas Ideal:Es un modelo teórico que supone que las moléculas de un gas no interactúan entre sí y siguen ciertas leyes, como la Ley de Boyle.
Ecuación de la Ley de Boyle
La relación entre presión y volumen se puede expresar matemáticamente mediante la ecuación de la Ley de Boyle:
P1 * V1 = P2 * V2
Donde:
P1: Representa la presión inicial del gas.V1: Representa el volumen inicial del gas.P2: Representa la presión final del gas.V2: Representa el volumen final del gas.
Esta ecuación muestra que el producto de la presión y el volumen de un gas es constante cuando la temperatura se mantiene constante. En otras palabras, si se duplica la presión de un gas, su volumen se reducirá a la mitad.
Es importante destacar que la Ley de Boyle es válida únicamente para gases ideales, es decir, aquellos que cumplen las condiciones ideales de baja presión y alta temperatura.
Cuál es la relación entre presión y volumen según la Ley de Boyle
La Ley de Boyle, también conocida como la Ley de Boyle-Mariotte, es una ley fundamental en la física que establece la relación inversa entre la presión y el volumen de un gas a temperatura constante. Fue formulada por el científico británico Robert Boyle en el siglo VII, y desde entonces ha sido uno de los pilares de la termodinámica y la física de gases.
Según la Ley de Boyle, si se mantiene constante la temperatura de un gas, el producto de su presión y volumen será constante. En otras palabras, cuando la presión aumenta, el volumen disminuye, y viceversa. Esto significa que si se duplica la presión, el volumen se reducirá a la mitad, y si se reduce la presión a la mitad, el volumen se duplicará.
Para entender mejor esta relación, podemos pensar en un recipiente cerrado con un gas en su interior. Si aplicamos una fuerza para comprimir el gas, aumentaremos la presión y, como consecuencia, el volumen del gas se reducirá. Por otro lado, si liberamos la fuerza de compresión, la presión disminuirá y el gas ocupará un mayor volumen.
Es importante destacar que la Ley de Boyle solo es válida si la temperatura se mantiene constante. Si cambiamos la temperatura del gas, se debe utilizar la Ley de Boyle combinada con la Ley de Gay-Lussac o la Ley de Charles para obtener resultados precisos.
Aplicaciones prácticas de la Ley de Boyle
La Ley de Boyle tiene numerosas aplicaciones prácticas en diferentes campos de la ciencia y la tecnología. Algunas de ellas incluyen:
Buceo:En el buceo, la Ley de Boyle es fundamental para comprender los efectos de la presión en el cuerpo humano durante las inmersiones. A medida que se desciende a mayores profundidades, la presión ambiente aumenta y el volumen de los gases en los pulmones disminuye. Esto requiere un adecuado control de la respiración y la utilización de equipos especiales.Fabricación de productos:En la industria, la Ley de Boyle es aplicada en numerosos procesos de fabricación. Por ejemplo, en la producción de envases a presión como latas de aerosol o botellas de bebidas carbonatadas, se utiliza la presión para comprimir el gas dentro del recipiente, evitando así que se escape antes de su uso.Sistemas de frenado:Los sistemas de frenado hidráulicos, presentes en automóviles y maquinarias pesadas, también se basan en la Ley de Boyle. La aplicación de presión en los frenos conduce a una reducción del volumen del fluido, lo cual genera la fuerza necesaria para detener el movimiento de los vehículos.
Estos son solo algunos ejemplos de cómo la Ley de Boyle se aplica en la vida cotidiana y en diferentes áreas de la ciencia y la ingeniería. Esta ley es una herramienta fundamental para comprender el comportamiento de los gases y su relación con la presión y el volumen, permitiendo el desarrollo de múltiples innovaciones tecnológicas.
Cómo se puede expresar matemáticamente la Ley de Boyle
La Ley de Boyle es una ley fundamental en la física que establece la relación entre la presión y el volumen de un gas. Fue descubierta por el científico Robert Boyle en el siglo VII y desde entonces ha sido una herramienta invaluable en el estudio de los gases.
La expresión matemática de la Ley de Boyle establece que, a temperatura constante, el producto de la presión y el volumen de un gas es siempre igual a una constante:
P * V = k
Donde P representa la presión del gas, V representa el volumen y k es la constante de proporcionalidad. Esta fórmula nos permite entender cómo una variación en la presión afecta al volumen de un gas, y viceversa.
De acuerdo con la Ley de Boyle, si mantenemos la temperatura constante, cuando la presión de un gas aumenta, su volumen disminuye proporcionalmente, y viceversa. Esto se debe a que las partículas de gas están en constante movimiento y chocan contra las paredes del recipiente en el que se encuentran, generando una fuerza que ejerce presión. Si aumentamos la presión, estas colisiones serán más frecuentes y los choques serán más intensos, lo que reduce el espacio disponible para las partículas y disminuye el volumen del gas.
Por el contrario, si disminuimos la presión, las colisiones de las partículas serán menos frecuentes y menos energéticas, lo que permite que el gas ocupe más espacio y su volumen se incremente.
Esta relación inversa entre presión y volumen se puede observar fácilmente en un experimento simple. Tomemos como ejemplo un recipiente cerrado con un émbolo móvil. Si ejercemos una fuerza sobre el émbolo para disminuir el volumen del gas contenido en el recipiente, observaremos que la presión aumenta. Si liberamos la fuerza y permitimos que el émbolo retroceda, veremos que la presión disminuye mientras el volumen se incrementa.
La Ley de Boyle es de suma importancia en diversas aplicaciones prácticas. Por ejemplo, en la industria automotriz, se utiliza para monitorear y controlar la presión de los neumáticos. La correcta presión de inflado garantiza un desempeño óptimo del vehículo, al tiempo que asegura la seguridad de los ocupantes. Además, esta ley es fundamental en la comprensión de fenómenos como la respiración, ya que juega un papel crucial en el intercambio de gases en los pulmones.
La Ley de Boyle establece una relación inversa entre la presión y el volumen de un gas a temperatura constante. Esto significa que cuando la presión aumenta, el volumen disminuye y viceversa. Su expresión matemática, P * V = k, nos permite comprender cómo estas dos variables están relacionadas y cómo su variación afecta al comportamiento de los gases.
Cuáles son algunos ejemplos cotidianos que demuestran la Ley de Boyle
La Ley de Boyle, también conocida como la ley de la presión de los gases, fue descubierta por el científico Robert Boyle en el siglo VII. Esta ley establece una relación inversamente proporcional entre la presión y el volumen de un gas a temperatura constante.
Para entender mejor esta relación, es útil analizar algunos ejemplos cotidianos que demuestran la Ley de Boyle en acción:
1. Globo inflado:Imagina que tienes un globo inflado en tus manos. Si comienzas a presionarlo suavemente con tus dedos, notarás cómo el volumen del globo disminuye mientras que la presión interna aumenta. Esto se debe a que al aplicar presión sobre el globo, los átomos y moléculas de gas en su interior se ven forzados a ocupar menos espacio, lo que provoca una disminución en el volumen.2. Jeringa:Otro ejemplo interesante de la Ley de Boyle se encuentra en el funcionamiento de una jeringa. Al tirar del émbolo hacia atrás, creas un espacio vacío dentro de la jeringa que tiene una menor presión. Debido a la diferencia de presiones, el líquido o gas presente en la aguja de la jeringa fluye hacia el interior del cilindro de manera espontánea para equilibrar las presiones.3. Botellas de plástico:Si alguna vez has intentado abrir una botella de plástico que ha sido previamente cerrada cuando tenía un contenido gaseoso, habrás notado que es difícil de abrir. Esto se debe a que el gas en el interior de la botella está sometido a una mayor presión debido a su volumen reducido. Al abrir la tapa, se igualan las presiones y el volumen del gas aumenta rápidamente, lo cual puede resultar en un ruido característico.
Estos son solo algunos ejemplos prácticos que ilustran la Ley de Boyle en nuestra vida diaria. Es importante tener en cuenta que la ley se aplica a temperaturas constantes, por lo que si se modifica la temperatura, los resultados pueden variar. Sin embargo, la relación entre presión y volumen sigue siendo fundamental para comprender comportamientos y fenómenos en diferentes áreas de la ciencia y la tecnología.
Qué experimento clásico demostró la validez de la Ley de Boyle
La Ley de Boyle es un principio fundamental en el estudio de la física de los gases. Establece una relación inversa entre la presión y el volumen de un gas, siempre que la temperatura se mantenga constante. Esta ley fue formulada por el científico inglés Robert Boyle en el siglo VII y fue resultado de uno de los primeros experimentos científicos sistemáticos llevados a cabo en la historia de la ciencia.
El experimento clásico que demostró la validez de la Ley de Boyle consistió en utilizar un tubo de vidrio cerrado en un extremo con mercurio y gas encerrado en el otro extremo. Al variar la presión aplicada sobre el mercurio, Boyle observó que el volumen del gas se comportaba de manera inversamente proporcional a la presión. Cuanto mayor era la presión ejercida sobre el mercurio, menor era el volumen ocupado por el gas, y viceversa.
Boyle estableció entonces que, a temperatura constante, si se duplica la presión sobre un gas, el volumen disminuye a la mitad, y si se reduce a la mitad la presión aplicada, el volumen del gas se duplica. Esto se debe a que las partículas de gas ejercen fuerzas unas sobre otras y contra las paredes del recipiente. Cuando se aumenta la presión, estas fuerzas se incrementan y las partículas se agrupan más estrechamente, disminuyendo el volumen. Por el contrario, al reducir la presión, estas fuerzas se disminuyen y las partículas se dispersan, aumentando el volumen ocupado.
En la actualidad, la Ley de Boyle sigue siendo utilizada en numerosos campos de la ciencia y la tecnología. Por ejemplo, es fundamental en el diseño y funcionamiento de sistemas de aire acondicionado, compresores y gasoductos. Además, esta ley establece las bases para la comprensión de fenómenos como la expansión y contracción de gases en globos aerostáticos o submarinos.
Cuál es la implicación de la Ley de Boyle en los sistemas de ventilación y compresión de gases
La Ley de Boyle, también conocida como la Ley de la Presión- Volumen, establece que a temperatura constante, el volumen de un gas es inversamente proporcional a la presión que se ejerce sobre él. Esto significa que si aumentamos la presión aplicada a un gas, su volumen disminuirá, y viceversa.
Aplicaciones en sistemas de ventilación
Esta ley tiene diversas aplicaciones prácticas, especialmente en el campo de la ventilación. En los sistemas de ventilación, la Ley de Boyle nos dice que podemos controlar la cantidad de aire que entra o sale de un espacio cerrado manipulando la presión. Por ejemplo, si queremos aumentar la cantidad de aire fresco que ingresa a una habitación, simplemente podemos disminuir la presión dentro de la habitación, lo que creará una diferencia de presiones y permitirá que el aire del exterior fluya hacia adentro.
Además, esta ley también juega un papel importante en la eficiencia energética de los sistemas de ventilación. Si el diseño del sistema es adecuado y logramos mantener una presión constante, podemos garantizar un flujo de aire óptimo y minimizar las pérdidas energéticas.
Compresión de gases
Otra aplicación común de la Ley de Boyle es en los procesos de compresión de gases. Al ejercer presión sobre un gas, como ocurre en un cilindro de gas comprimido, podemos reducir su volumen considerablemente. Esto es de vital importancia en diversas industrias y sectores, desde la producción de alimentos y bebidas hasta la generación de energía.
La Ley de Boyle nos permite comprimir gases para aumentar su densidad y facilitar su almacenamiento y transporte. De esta manera, se pueden manejar grandes cantidades de gas en espacios más reducidos, lo que resulta muy práctico y eficiente desde el punto de vista logístico.
Consideraciones adicionales
Es importante tener en cuenta que la Ley de Boyle es válida únicamente si la temperatura se mantiene constante. Si la temperatura varía, es necesario aplicar la Ley de los Gases Ideales, que toma en cuenta la variación de la temperatura además de la presión y el volumen del gas.
La Ley de Boyle es fundamental para comprender la relación entre presión y volumen en sistemas de ventilación y compresión de gases. Su aplicación nos permite controlar el flujo de aire en espacios cerrados y optimizar la eficiencia energética de los sistemas de ventilación. Además, también es clave en procesos de compresión de gases, facilitando su almacenamiento y transporte en diversas industrias. Es una ley que ha revolucionado la forma en que interactuamos con los gases en nuestra vida cotidiana.
Cómo se relaciona la Ley de Boyle con los buceadores y el fenómeno de la presión submarina
La Ley de Boyle, también conocida como la Ley de la Presión y el Volumen, establece que a temperatura constante, el volumen de una cantidad dada de gas es inversamente proporcional a la presión aplicada sobre él. En términos más simples, cuando la presión aumenta, el volumen disminuye, y viceversa.
Esta ley es de suma importancia en diversas áreas, incluyendo el buceo. Los buceadores se encuentran constantemente expuestos a cambios de presión a medida que se sumergen a diferentes profundidades en el agua. A mayor profundidad, la presión en el entorno submarino aumenta considerablemente, lo que puede afectar tanto al buceador como a su equipo.
Cuando un buceador se sumerge, la presión del agua ejerce una fuerza sobre su cuerpo y sus sistemas respiratorios. Para evitar posibles daños o accidentes, es fundamental para los buceadores comprender la relación entre la presión y el volumen, y cómo la Ley de Boyle se aplica en este contexto.
Imagina que un buceador se sumerge a una cierta profundidad y, debido al aumento de la presión, su capacidad pulmonar disminuye. Esto se debe a que la presión del agua comprime el aire dentro de sus pulmones, reduciendo así su volumen. Sin embargo, si el buceador asciende hacia la superficie, donde la presión disminuye, experimentará una expansión en la capacidad pulmonar, ya que el aire dentro de sus pulmones se expande a medida que la presión disminuye.
Además de los efectos en el cuerpo humano, la Ley de Boyle también tiene implicaciones en el equipo de buceo. Por ejemplo, los tanques de aire comprimido utilizados por los buceadores contienen una cierta cantidad de gas bajo presión. A medida que el buceador se sumerge, la presión aumenta y la cantidad de gas disponible disminuye, lo que limita el tiempo de inmersión.
La Ley de Boyle es fundamental para comprender cómo la relación entre la presión y el volumen afecta a los buceadores y al fenómeno de la presión submarina. Tanto el cuerpo humano como el equipo de buceo experimentan cambios significativos debido a las variaciones en la presión a medida que se sumergen o ascienden. Es vital que los buceadores comprendan esta relación para garantizar su seguridad y bienestar durante las inmersiones.
Cómo se puede aplicar la Ley de Boyle en la medicina, particularmente en los respiradores artificiales
La Ley de Boyle, también conocida como la Ley de los gases ideales, establece que a temperatura constante, el volumen de un gas es inversamente proporcional a su presión. En otras palabras, si aumentamos la presión de un gas, su volumen disminuirá y viceversa.
Esta ley tiene una amplia gama de aplicaciones en diversos campos, incluyendo la medicina. Un área en la que se aplica la Ley de Boyle es en los respiradores artificiales.
Los respiradores artificiales son dispositivos utilizados para asistir o reemplazar la función respiratoria en personas que no pueden respirar por sí mismas. Funcionan aplicando presión al aire para controlar la entrada y salida de oxígeno y dióxido de carbono en los pulmones del paciente.
Mediante el uso de la Ley de Boyle, los respiradores artificiales son capaces de regular la presión y el volumen del aire suministrado al paciente de manera controlada. Cuando se aplica presión al aire dentro del respirador, el volumen de este disminuye, lo que permite una mayor entrada de oxígeno en los pulmones del paciente. Por otro lado, cuando se reduce la presión en el respirador, el volumen del aire aumenta y facilita la exhalación del dióxido de carbono acumulado en los pulmones.
Es importante resaltar que los respiradores artificiales deben ser cuidadosamente configurados y monitoreados por personal médico capacitado. El ajuste incorrecto de la presión del aire podría causar daño a los pulmones del paciente.
Además de los respiradores artificiales, la Ley de Boyle también tiene aplicaciones en otros dispositivos médicos, como los espirómetros. Estos instrumentos se utilizan para medir la capacidad pulmonar y evaluar el funcionamiento adecuado de los pulmones. Al cambiar la presión del aire dentro del espirómetro, se puede determinar cómo varía el volumen del aire cuando se inhala o se exhala.
La Ley de Boyle es fundamental en la medicina, especialmente en el diseño y funcionamiento de dispositivos como los respiradores artificiales y los espirómetros. Su comprensión y aplicación adecuada permiten regular la presión y el volumen del aire suministrado a los pacientes, mejorando así su función respiratoria y contribuyendo a su bienestar general.
Cuáles son las limitaciones y excepciones a la Ley de Boyle
La Ley de Boyle, también conocida como la ley de los gases ideales, establece que a temperatura constante, el volumen de un gas es inversamente proporcional a su presión. Sin embargo, esta ley tiene ciertas limitaciones y excepciones que es importante tener en cuenta.
Limitaciones de la Ley de Boyle
Si bien la Ley de Boyle es válida para los gases ideales, en la práctica existen algunos factores que pueden limitar su aplicabilidad. Uno de ellos es la temperatura. La ley asume una temperatura constante durante el proceso, pero en realidad, los gases pueden experimentar cambios de temperatura que afectan su comportamiento. Asimismo, esta ley no es aplicable a condiciones extremas, como altas presiones o bajas temperaturas.
Otra limitación de la Ley de Boyle es que solo es válida para gases que no experimentan cambios químicos o físicos durante el proceso. Si el gas se somete a una reacción química o se condensa, la relación entre presión y volumen ya no sigue el mismo patrón establecido por la ley.
Excepciones a la Ley de Boyle
A pesar de ser una ley fundamental en la termodinámica de los gases, existen algunas situaciones en las cuales la Ley de Boyle no se cumple. Una de ellas es cuando el gas se encuentra a altas presiones y volúmenes muy bajos, cerca del punto de condensación. En estas condiciones, las fuerzas intermoleculares comienzan a tener un papel más relevante y la relación entre presión y volumen se desvía de la predicción de la ley.
Otra excepción se presenta cuando el gas se encuentra a temperaturas muy bajas, cerca del cero absoluto. En estas condiciones, los gases pueden comportarse de manera no ideal y la relación entre presión y volumen puede variar significativamente.
Conclusion
A pesar de las limitaciones y excepciones mencionadas, la Ley de Boyle sigue siendo una herramienta fundamental para comprender cómo los cambios en la presión afectan al volumen de un gas. Si bien no es aplicable en todas las situaciones, proporciona una base sólida para el estudio de la termodinámica de los gases y continúa siendo ampliamente utilizada en numerosas aplicaciones prácticas.
Cuáles son algunas fuentes adicionales para aprender más sobre la Ley de Boyle
La Ley de Boyle, también conocida como la ley de compresibilidad de los gases, establece una relación inversa entre la presión y el volumen de un gas a temperatura constante. Fue formulada por el científico irlandés Robert Boyle en el siglo VII y es uno de los principios fundamentales de la física de los gases.
Si deseas aprender más sobre la Ley de Boyle y profundizar tus conocimientos sobre esta importante ley física, existen diversas fuentes adicionales a las que puedes recurrir. A continuación, te presentamos algunas de ellas:
1. Libros de texto especializados
Los libros de texto de física generalmente incluyen un capítulo dedicado a las leyes de los gases ideales, donde se aborda de manera detallada la Ley de Boyle. Algunos libros recomendados son "Física Universitaria" de Sears, Zemansky y Young, y "Fundamentos de Física" de Halliday, Resnick y Walker. Estos libros explican los conceptos de manera clara y proporcionan ejemplos y problemas resueltos para afianzar la comprensión.
2. Recursos en línea
Internet ofrece una amplia gama de recursos en línea para aprender sobre la Ley de Boyle. Sitios web educativos como Khan Academy, Coursera y ed ofrecen cursos gratuitos en línea de física y ciencias relacionadas donde se abordan las leyes de los gases, incluyendo la Ley de Boyle. Estos cursos suelen contar con videos explicativos, lecturas complementarias y ejercicios prácticos para reforzar el aprendizaje.
3. Videos educativos
Plataformas de videos como YouTube y Vimeo albergan una gran cantidad de contenido educativo relacionado con la física. Busca canales especializados en ciencias o educación que aborden el tema de la Ley de Boyle. Estos canales suelen contar con videos explicativos, animaciones y experimentos prácticos para ayudarte a comprender mejor los conceptos relacionados con la relación entre presión y volumen.
4. Revistas científicas
Si deseas profundizar aún más en el estudio de la Ley de Boyle y su aplicación en la ciencia actual, puedes consultar revistas científicas especializadas. Algunas revistas recomendadas son "The Journal of Physical Chemistry" y "Physics Today". Estas revistas publican artículos de investigación y revisiones científicas que tratan sobre los fundamentos teóricos y las aplicaciones prácticas de la ley de compresibilidad de los gases.
Las fuentes adicionales para aprender más sobre la Ley de Boyle son variadas y accesibles. Ya sea mediante libros de texto, recursos en línea, videos educativos o revistas científicas, siempre hay formas de expandir tu conocimiento sobre esta importante ley física. Aprovecha estas fuentes adicionales y adéntrate en el fascinante mundo de la relación entre presión y volumen de los gases.
Preguntas frecuentes (FAQ)
1. ¿Qué es la Ley de Boyle?
La Ley de Boyle establece que, a temperatura constante, el volumen de un gas es inversamente proporcional a la presión que se le aplica.
2. ¿Cuál es la fórmula de la Ley de Boyle?
La fórmula de la Ley de Boyle es: P1 x V1 = P2 x V2, donde P1 y V1 son la presión y el volumen iniciales del gas, y P2 y V2 son la presión y el volumen finales, respectivamente.
3. ¿Cómo afecta la presión al volumen de un gas?
Si se aumenta la presión aplicada a un gas, su volumen disminuirá. Por el contrario, si se disminuye la presión, el volumen del gas aumentará.
4. ¿Cuál es la unidad de medida de la presión y el volumen en la Ley de Boyle?
La presión se suele medir en atmósferas (atm) o en pascales (Pa), mientras que el volumen se puede medir en litros (L) o metros cúbicos (m³).
5. ¿En qué situaciones se aplica la Ley de Boyle en la vida cotidiana?
La Ley de Boyle se aplica en diversos campos, como la física, la química y la medicina. Algunos ejemplos de su aplicación en la vida cotidiana incluyen el funcionamiento de los infladores de bicicletas, el buceo y la respiración bajo el agua.

Entradas relacionadas